
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение теоретически необходимого количества воздуха
|
|
|
|
Горение – это реакция соединения горючих элементов топлива (H, C, S) с окислителем.
Горение называют химически полным, если в результате процесса горения образуются продукты полного окисления.
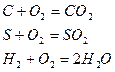
При отсутствии избыточного кислорода состав продуктов сгорания при полном горении выражается уравнением:
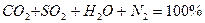
Если в процессе горения образуются газообразные продукты неполного окисления (CO, H и др.), то горение называется химически неполным.
и др.), то горение называется химически неполным.
Теоретически необходимым количеством воздуха (V0) называется объем воздуха при нормальных условиях, который требуется для полного сгорания единицы топлива  или
или .
.
Для определения данной величины V0 запишем стехиометрические химические реакции горения.
Для твердого и жидкого топлива, состав которых выражается в процентах веса, эти реакции (стехиометрические соотношения) имеют вид:
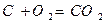
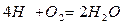

12кг+32кг=44кг 4кг+32кг=36кг 32кг+32кг=64кг или
1кг+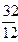 кг=
кг=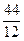 кг 1кг+8кг=9кг 1кг+1кг=2кг
кг 1кг+8кг=9кг 1кг+1кг=2кг
Согласно закону сохранения масс (где 12, 32, 44 и т.д. – атомарные и молекулярные веса реагирующих веществ и продуктов реакций.
На основании вышеприведенных реакций и учитывая, что воздух содержит 21% кислорода по объёму, получим:
 , где
, где 
 - вес О2 для окисления 1кг топлива
- вес О2 для окисления 1кг топлива
 - плотность кислорода при нормальных условиях (
- плотность кислорода при нормальных условиях ( - молекулярный вес О2,
- молекулярный вес О2,  - объём 1 кмоля идеального газа при н.у.)
- объём 1 кмоля идеального газа при н.у.)
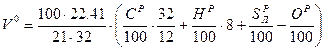
 .
.

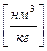
Для газообразного топлива состав выражается в процентах объема. Запишем стехиометрические соотношения процесса окисления горючих компонентов газообразного топлива, учитывая, что 1 кмоль любого газа при нормальных условиях занимает один и тот же объем (22,41 нм3/кмоль). Закона сохранения объёма не существует.
2H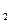 +O
+O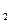 =2H
=2H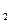 O; 2CO + O
O; 2CO + O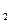 = 2CO
= 2CO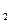 ; CH
; CH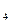 +2O
+2O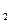 =CO
=CO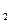 +2H
+2H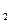 O
O
2м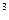 1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3
1м3 2м3 2м3 1м3 2м3 1м3 2м3 1м3 2м3
1м3 0.5м3 1м3 1м3 0,5м3 1м3
2H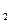 S+3O
S+3O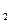 =2H
=2H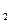 O+2SO
O+2SO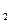
2м3 3м3 2м3 2м3
1м3 1.5м3 1м3 1м3
Таким образом, теоретически необходимый объем воздуха для сжигания газ. топлива
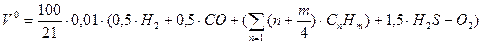
 ,
,
где H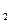 , CO … - в процентах объема.
, CO … - в процентах объема.
Коэффициент избытка воздуха
Поскольку процесс перемешивания топлива с воздухом неидеален, то для обеспечения полного сгорания топлива, необходимо подавать воздуха в топку больше  .
.
Коэффициентом избытка воздуха (α) называется отношение действительного количества воздуха ( 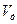 ) к теоретически необходимому (
) к теоретически необходимому (  ).
).
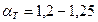

- для твердого топлива;
 - для газа и мазута (топка под разрежением);
- для газа и мазута (топка под разрежением);
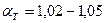 - для газа и мазута (топка “под наддувом”).
- для газа и мазута (топка “под наддувом”).
Определение объёмов продуктов сгорания
При полном сгорании топлива и α=1 объем газа  состоит из объема трехатомных газов, объема азота и объема водяных паров.
состоит из объема трехатомных газов, объема азота и объема водяных паров.
 , где
, где
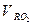 =
= +
+ - объем трехатомных газов
- объем трехатомных газов
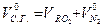 - объем сухих газов
- объем сухих газов
Для определения объема указанных составляющих, снова используем вышеприведенные реакции горения.
При сжигании твердого и жидкого топлива (состав в % веса)
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!