
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория гибридизации
|
|
|
|
Попытки применения МВС в простейшем варианте, изложенном выше для описания химического строения большинства молекул состоящих из 3 и более атомов оказались неудачными. Во многих случаях теория абсолютно не соответствовала экспериментальным данным. Для устранения этого противоречия была разработана теория гибридизации.
Гибридизация - это глубокая перестройка АО, возникающая при переходе атома из нормального в возбужденное состояние. При этом АО превращаются в ГАО (гибридные атомные орбитали). ГАО резко отличаются от исходных АО по энергии, форме и ориентации в пространстве. В то же время ГАО одного атома абсолютно одинаковы по энергии и форме между собой.
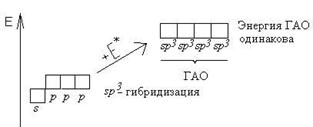
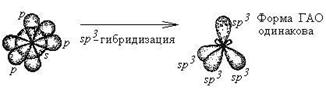
Все ГАО имеют форму ассиметричной гантели (т.е. вытянуты в одном направлении). Гибридизации могут подвергаться только орбитали валентных подуровней. В ходе гибридизации из n АО получаются n ГАО. ГАО участвуют вобразовании только s - связеи, причем эти связи более прочные, чем аналогичные s - связи с участием негибридных АО.
В настоящее время в различных веществах обнаружено около 20 различных типов гибридизации. Но чаще всего встречаются 6 типов гибридизации:
| Тип гибридизации | Взаимное расположение ГАО в пространстве | Структурные формы | Геометрическая фигура |
| sp |

|

| Линейная |
| sp2 |

|
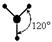
| Тригональная плоская |
| sp3 | 

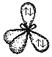
|
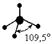
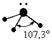
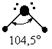
| Тетраэдрическая Тригональная пирамида Угловая |
| sp3d1 | 
|
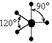
| Тригональная бипирамида |
| sp3d2 | 
|
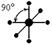
| Октаэдр |
| spd2 | 
| 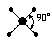
| Плоский квадрат |
Наличие гибридизации и ее тип у того или иного атома в молекуле в общем случае предсказать нельзя. Для однозначного решения этой задачи в большинстве случаев нужно знать:
1. Сколько связей между каждой парой атомов (первая связь - всегда s - связь, вторая и третья - p - связи).
2. Чему равны валентные углы (углы между связями) или, по крайней мере, чему равен дипольный момент молекулы (сумма дипольных моментов связей).
Пример 1. Известно, что молекула CСl4 неполярна (½m½ = 0). Углы между связями С - Сl одинаковы и равны 109°28¢. Все связи C - Cl одинаковы по длине и энергии. Все эти данные свидетельствуют в пользу того факта, что углерод в этой молекуле находится в состоянии sp3 - гибридизации.
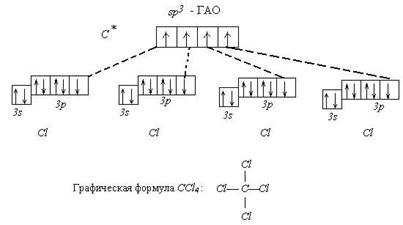 Поэтому орбитальная диаграмма выглядит следующим образом:
Поэтому орбитальная диаграмма выглядит следующим образом:
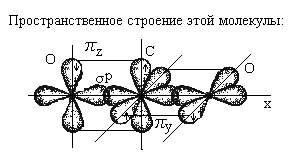
Пространственноестроение CCl4 (атомы Cl образуют правильную фигуру - тетраэдр):
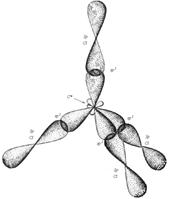
Относительно возможной гибридизации атомов хлора ничего сказать нельзя, т.к. исходных данных недостаточно для этого.
Пример 2. Молекула Н2О полярна (çm ç ¹ 0), угол между связями Н-О равен 105°30¢. Водород не может подвергаться гибридизации, так как у него всего одна валентная орбиталь. Кислород может быть негибридизированным (тогда угол между связями должен быть 90°) или иметь один из 3 типов гибридизации (другие невозможны из-за отсутствия валентных d и f - орбиталей): sp - гибридизация (валентный угол 180°), sp2 - гибридизация (120°), sp3 - гибридизация (109°28¢).
Так как валентный угол в молекуле воды наиболее близок к таковому для случая sp3 - гибридизации, орбитальная диаграмма этой молекулы следующая:
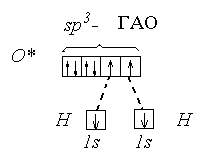
Валентный угол в такой молекуле отличается от стандартного тетраэдрического (109°28¢) за счет того, что ГАО кислорода неравноценны: две из них связывающие (принимают участие в образовании связей О - Н), а две - несвязывающие:
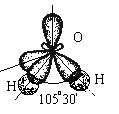
Несвязывающие атомные орбитали кислорода сильно отталкиваются друг от друга и это приводит к тому, что валентный угол в молекуле воды меньше на 5° относительно стандартного для sp 3 гибридизации.
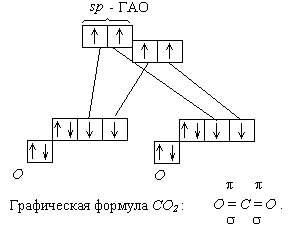
Пример 3: Молекула СО2 неполярна (çm ç = 0). Этого вполне достаточно, чтобы описать строение этой молекулы. Каждая связь С - О является полярной, так как атомы углерода и кислорода сильно отличаются по электроотрицательности. Чтобы молекула в целом была неполярной, необходимо чтобы связи С - О имели валентный угол равный 180°:
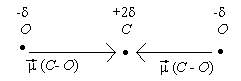
При сложении 2 векторов одинаковых по длине и противополжных по направлению получается ноль. Угол 180° соответствует sp -гибридизации атома углерода. Отсюда следует орбитальная диаграмма:
ТЕМА 4. ХИМИЧЕСКАЯ КИНЕТИКА И УЧЕНИЕ О
ХИМИЧЕСКОМ РАВНОВЕСИИ
Вопросы программы:
1. Что такое скорость химической реакции? От каких факторов она зависит?
2. Зависимость скорости реакции от природы реагирующих веществ, концентрации и температуры.
3. Катализ. Катализаторы.
4. Обратимость химических реакций. Химическое равновесие.
5. Константа химического равновесия.
6. Смещение химического равновесия. Принципы Ле-Шателье.
Химическая кинетика - это раздел химии, изучающий скорости химических реакций и их механизм. Все химические взаимодействия можно разделить на гомогенные и гетерогенные.
Гомогенные реакции - это процессы, протекающие по всему объему смеси реагирующих веществ. Любая реакция, идущая в смеси газов, смеси жидкостей или в смеси жидких растворов является гомогенной. Например, если смешать газообразные водород и хлор, а затем эту смесь нагреть, то пойдет гомогенное взаимодействие по уравнению Н2 + Сl2 = 2НСl.
Гетерогенные реакции - это процессы, протекающие на границе раздела между взаимодействующими веществами. Например, горение углерода в кислороде является гетерогенным процессом: C + O2 = CO2. Эта реакция протекает на поверхности раздела двух фаз (твердый углерод - газообразный кислород).
Скорость химической реакции - это количество элементарных актов химического взаимодействия за единицу времени. Для гомогенной реакции скорость (v) можно определить как изменение концентрации одного из исходных веществ или продуктов за единицу времени:
v = 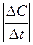 ,
,
где: D С - изменение концентрации одного из веществ (исходного или продукта); D t - промежуток времени, за который произошло это изменение.
Для гетерогенных реакций в данном определении параметр D С следует заменить на D n (изменение количества вещества одного из реагентов или продуктов реакции). В приведенном выше уравнении имеет место модуль, т.к. скорость химической реакции не может быть отрицательной величиной.
(изменение количества вещества одного из реагентов или продуктов реакции). В приведенном выше уравнении имеет место модуль, т.к. скорость химической реакции не может быть отрицательной величиной.
Величина скорости гомогенной реакции определяется 4 факторами:
1. Природой реагирующих веществ.
2. Концентрацией реагирующих веществ.
3. Температурой.
4. Наличием в системе того или иного катализатора.
Природа реагирующих веществ.
Это, пожалуй, самый главный параметр, который определяет не только скорость взаимодействия, но и саму возможность протекания реакции. Так, например, цезий при соприкосновении с горячей водой взрывается. Литий взаимодействует с горячей водой достаточно активно, но без взрыва. С той же горячей водой магний взаимодействует очень вяло, а медь - вообще не взаимодействует. К сожалению, математическая зависимость скорости химической реакции от природы реагентов в настоящее время неизвестна. Поэтому, здесь можно рассуждать только на качественном уровне.
Концентрация реагирующих веществ.
Зависимость скорости реакции от концентрации выражается законом действия масс:
cкорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам (т.е. тем коэффициентам, которые пишутся в уравнении реакции перед формулами веществ).
nA + mB = An Bm;
v = k × [ A ]n × [ B ]m,
где v - скорость реакции при постоянной температуре; [ A ] - концентрация исходного вещества А (моль/дм3); [ B ] - концентрация исходного вещества В (моль/дм3); k - константа скорости реакции.
Константа скорости в уравнении закона действующих масс является константой только по одному параметру - концентрации. Величина константы скорости реакции определяется природой веществ А и В, температурой и катализатором (если он введен в систему). Другими словами, в константе скорости ”спрятана” зависимость скорости реакции от всех факторов, кроме концентрации реагирующих веществ.
Следует учесть, что приведенное выше уравнение является верным, если данное взаимодействие протекает в одну стадию. Если реакция идет через ряд промежуточных стадий, общая скорость реакции равна скорости самой медленной стадии процесса (для этого необходимо знать реальный механизм данного взаимодействия). В дальнейшем, для простоты, будем считать все рассматриваемые процессы одностадийными.
Примеры: 1) H2(г) + J2(г) = 2 HJ(г)
(гомогенная реакция)
v1 = k1 [H2] [J2].
2) 2 СO(г) + O2(г) = 2 СO2(г)
(гомогенная реакция)
v2 = k2 [CO]2 [O2].
3) C(т) + O2(г) = CO2(г)
(гетерогенная реакция)
v3 = k3 [O2].
В последнем примере концентрацию твердого углерода изменить нельзя (по сути, это его плотность, выраженная в единицах моль/дм3). Поэтому величина [С(т)] входит в константу скорости k3.
Температура.
Скорость химической реакции очень сильно зависит от температуры, при которой происходит взаимодействие веществ: чем выше температура, тем быстрее идет это взаимодействие. Математически эта зависимость может быть задана двумя способами: правилом Вант-Гоффа и уравнением Аррениуса.
Правило Вант-Гоффа: cкорости большинства химических реакций увеличиваются в 2 - 4 раза при увеличении температуры на каждые 10 °С.
(t2 - t1) / 10°
v (t2) = v (t1) × ¡,
где v (t1) - скорость реакции при температуре t1; v (t2) - скорость реакции при температуре t2; ¡ - температурный коэффициент Вант-Гоффа (показывает, во сколько раз увеличивается скорость данной реакции при D t = t2 - t1 = 10 °C); t1 и t2 - начальная и конечная температуры, при которых измерялась скорость реакции.
Пример: температурный коэффициент некоторой реакции равен 2. Во сколько возрастет скорость этой реакции при увеличении температуры от 20 до 120°С?
(t2 - t1) / 10°
v (t2) = v (t1) ס
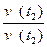 =
= 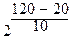 =
=  = 1024.
= 1024.
Ответ: скорость данной реакции увеличится в 1024 раза.
Правило Вант-Гоффа найдено экспериментально и не является законом. Температурный коэффициент (¡) для большинства химических реакций имеет постоянное значение только в довольно узком интервале температур (как правило, D t не более 100 °С), за пределами которого заметно изменяется (увеличивается или уменьшается).
Точная зависимость скорости реакции от температуры задается уравнением Аррениуса:
k = A × 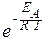 ,
,
где k - константа скорости реакции при температуре Т; A - постоянная, которая зависит только от природы взаимодействующих веществ; R - универсальная газовая постоянная; T - температура по шкале Кельвина (К); e - основание натурального логарифма (2,718); E A - энергия активации.
Уравнение Аррениуса является следствием теории активных соударений. По этой теории, не любое столкновение молекул взаимодействующих веществ приводит к образованию продуктов. Большинство частиц в момент соударения имеет суммарную кинетическую энергию меньше некоторого минимального значения, которое называется энергией активации (Е А). Столкновение частиц с энергией Е < Е А не приводит к их взаимодействию и они разлетаются как упругие мячики после соударения друг с другом. Лишь малая часть молекул исходных веществ имеет суммарный запас энергии Е ³ ЕА. В этом случае соударение будет неупругим (или активным) и в результате его могут появиться новые молекулы (продукты реакции).
Величина энергии активации зависит только от природы реагирующих веществ и наличия в системе какого-либо катализатора.
Катализ.
Допустим, взаимодействие между веществами А и В протекает со скоростью v0 по уравнению:
A + B = AB v0.
Введем в данную систему некое вещество, которое в дальнейшем будем называть катализатором (К). Катализатор взаимодействует с веществом А со скоростью v1:
A + K = AK v1.
Промежуточный продукт (АК) взаимодействует с веществом В со скоростью:
AK + B = AB + K v2.
Итак, в присутствии катализатора процесс протекает более сложным образом:
A 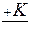 AK
AK 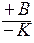 AB v3.
AB v3.
Cкорость такого взаимодействия (v3) равна скорости самой медленной стадии процесса (v3 = v1 или v3 = v2). Если v1 > v0 и v2 > v0, то v3 > v0, другими словами произошло увеличение скорости химической реакции в присутствии катализатора. При этом катализатор называют положительным катализатором. Если наоборот, v1 и v2 меньше v0, то катализатор называют отрицательным катализатором или ингибитором.
Катализатор - это вещество, изменяющее скорость реакции (увеличивающее или уменьшающее), но не входящее в состав продуктов взаимодействия. Реакции, протекающие в присутствии катализаторов называются каталитическими, а явление изменения скорости реакции в присутствии катализатора называется катализом.
По сути дела, катализатор изменяет энергию активации данной реакции. Положительный катализатор (часто его называют просто катализатором) уменьшает энергию активации, а отрицательный (ингибитор) - увеличивает.
Действие катализатора носит специфический характер. Так, например, оксид ванадия V2O5 ускоряет только процессы окисления с участием молекул кислорода (О2).
Положительные катализаторы и ингибиторы широко используются в промышленности и технике.
ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ПОНЯТИЕ О ХИМИЧЕСКОМ РАВНОВЕСИИ
Любая химическая реакция в принципе обратима, то есть может протекать как в прямом направлении (по уравнению - слева направо), так и в обратном (справа налево):
H2(г) + J2(г) 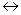 2 HJ(г).
2 HJ(г).
Если прямая реакция протекает очень сильно, а обратная - в очень малой степени, то такие реакции называют практически необратимыми и знак обратимости (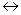 ) не ставят:
) не ставят:
C(т) + O2(г) = СO2(г).
Разложение оксида углерода (IV) на простые вещества - маловероятный процесс в обычных условиях и при нагревании до температур порядка 2000 °С и поэтому процесс можно считать (условно) необратимой реакцией.
Рассмотрим взаимодействие между водородом и азотом, которое является типичным случаем обратимой реакции:
3H2(г) + N2(г) 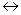 2 NH3(г).
2 NH3(г).
Допустим, в начальный момент времени были смешаны некоторые количества газообразных Н2 и N2. По закону действующих масс, скорость их взаимодействия (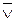 ) равна:
) равна:

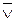 =
= 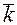 × [N2] × [H2]3.
× [N2] × [H2]3.
 |
Причем,
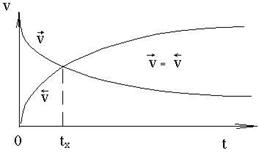
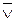 в момент смешивания будет максимальна, а по мере расходования исходных веществ постепенно будет убывать (см. рисунок).
в момент смешивания будет максимальна, а по мере расходования исходных веществ постепенно будет убывать (см. рисунок).
В начальный момент времени скорость обратной реакции (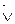 ) равна нулю, т.к. аммиака в системе нет (концентрация его равна нулю):
) равна нулю, т.к. аммиака в системе нет (концентрация его равна нулю):
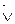 =
= 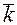 [NH3]2.
[NH3]2.
Но по мере протекания реакции 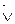 начинает возрастать. Через некоторый промежуток времени tx скорости прямой и обратной реакции сравняются. Такое состояние системы называется химическим равновесием. При этом прямой и обратный процессы не прекращаются, хотя видимых изменений в системе нет. В течение 1 секунды из азота и водорода образуется N молекул аммиака, но за это же время N молекул аммиака распадается на азот и водород. Иначе, концентрации [H2], [N2] и [NH3] остаются постоянными. Эти концентрации в состоянии равновесия называются равновесными концентрациями:
начинает возрастать. Через некоторый промежуток времени tx скорости прямой и обратной реакции сравняются. Такое состояние системы называется химическим равновесием. При этом прямой и обратный процессы не прекращаются, хотя видимых изменений в системе нет. В течение 1 секунды из азота и водорода образуется N молекул аммиака, но за это же время N молекул аммиака распадается на азот и водород. Иначе, концентрации [H2], [N2] и [NH3] остаются постоянными. Эти концентрации в состоянии равновесия называются равновесными концентрациями:
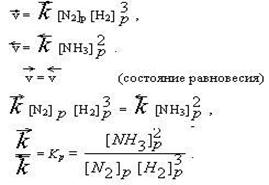 |
Отношение констант прямой и обратной реакции называется константой химического равновесия (Кр).
Константа равновесия определяет соотношение концентрации исходных веществ и продуктов реакции в состоянии химического равновесия. Величина константы равновесия зависит только от природы реагирующих веществ и температуры. Константа равновесия не зависит от концентрации веществ, на нее не влияет катализатор (он изменяет энергию активации прямой и обратной реакции в одинаковой степени, поэтому отношение констант скоростей остается постоянным).
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
Химическое равновесие является случаем устойчивого равновесия. Если система находится в состоянии равновесия и на нее не оказываются внешние воздействия, она будет находиться в этом состоянии бесконечно долго.
Некоторые воздействия (изменение температуры, изменение концентрации одного из веществ, изменение давления) могут вывести систему из состояния равновесия. Но за счет того, что система находится в состоянии именно устойчивого равновесия, она самопроизвольно возвращается опять в состояние равновесия.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия оказать какое-либо внешнее воздействие, выводящее ее из этого состояния, то в системе усилится тот процесс (прямая или обратная реакция), который возвратит систему в состояние равновесия.
Часто говорят о сдвиге (смещении) равновесия в системе: усиление прямой реакции приводит к смещению равновесия вправо (в сторону продуктов), а усиление обратной реакции смещает равновесие влево (в сторону исходных веществ).
Например, для обратимой реакции:
3H2(г) + N2(г) 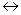 2NH3(г) + Q.
2NH3(г) + Q.
Внешнее воздействие влияет на равновесие следующим образом:
| Внешнее воздействие | Смещение равновесия |
| 1. Увеличение концентрации одного из исходных веществ (Н2 или N2) | 1. Вправо |
| 2. Уменьшение концентрации одного из исходных веществ (Н2 или N2) | 2. Влево |
| 3. Увеличение концентрации продукта | 3. Влево |
| 4. Уменьшение концентрации продукта (NH3) | 4. Вправо |
| 5. Увеличение температуры | 5. Влево (т.к. эндотермической является обратная реакция) |
| 6. Уменьшение температуры | 6. Вправо (т.к. эндотермической является прямая реакция) |
| 7. Увеличение давления | 7. Вправо (т.к. в уравнении данной реакции слева 4 моль газообразных веществ, а справа только 2 моль). |
| 8. Уменьшение давления | 8. Влево (см. пункт 7) |
Любое смещение равновесия для данной системы можно доказать двумя способами: по принципу Ле-Шателье или исходя из понятия о константе равновесия.
Например: произошло увеличение концентрации молекул Н2 (в реакционный сосуд ввели некоторое дополнительное количество газообразного водорода).
1. По принципу Ле-Шателье должна усиливаться та реакция, в ходе которой концентрация Н2 уменьшается, то есть водород расходуется. Это прямая реакция, а значит равновесие смещается вправо.
2. До внешнего воздействия система была равновесной, то есть выполнялось равенство:
Kp = 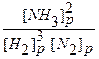 .
.
После введения в систему дополнительного количества водорода концентрации всех веществ стали неравновесными, т.к.:
Kp > 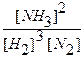 .
.
Чтобы система вернулась в состояние равновесия необходимо, чтобы увеличилась концентрация продукта (NH3) или уменьшились концентрации исходных веществ (H2 или N2). Если усилится прямая реакция, то произойдет и то и другое (концентрация NH3 увеличится, а концентрация H2 и N2 уменьшатся). Произойдет смещение равновесия вправо и концентрации веществ опять станут равновесными (но теперь уже будут иметь другие значения).
ТЕМА 5. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Вопросы программы:
1. Основные понятия: раствор, растворитель, типы растворов (по агрегатному состоянию).
2. Способы выражения концентрации растворов.
3. Коллигативные свойства растворов (осмос, закон Рауля).
Раствор - это гомогенная (однородная) система, состоящая из двух или более компонентов (химических веществ).
Один из компонентов считается растворителем, а остальные - растворенными веществами. Если вещества до смешивания находились в разных агрегатных состояниях, то растворителем считается тот компонент, агрегатное состояние которого имеет раствор. Например, при смешивании жидкой воды и твердого сахара получился жидкий раствор. В данном случае растворителем является вода, а сахар - растворенным веществом.
Если вещества в момент смешивания имели одинаковое агрегатное состояние, то растворителем считается тот компонент, которого больше по количеству вещества. Например, если смешать 180 г воды (10 моль) и 180 г этилового спирта (180 г / 40 г / моль = 3,9 моль), то растворителем является вода.
По агрегатному состоянию растворы можно разделить на газообразные, жидкие и твердые.
Примеры:
1) Газообразный раствор - воздух (N2 - растворитель; O2, CO2, H2O и т.д. - растворенные вещества).
2) Жидкий раствор - раствор сахара в воде.
3) Твердый раствор - сталь (Fe - растворитель; С и другие элементы - растворенные вещества).
Способы выражения концентрации растворов
Таких способов существует множество, но чаще всего используется 6 перечисленных ниже. Символом X будет обозначаться формула того вещества, концентрация которого определяется данным выражением (Х =NaCl, H2SO4, KOH и т.д.)
I. Массовая доля (w) - это отношение массы растворенного вещества к общей массе раствора:
w (X) = 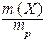 ;
;
Массовая доля - безразмерная величина. Сумма массовых долей всех веществ в растворе = 1. Массовая доля может быть выражена в процентах. В этом случае она находится по формуле:
w (X) =  × 100,
× 100,
II. Мольная доля (х) - отношение количества вещества Х (моль) к общему числу молей всех веществ в растворе.
х (Х) = 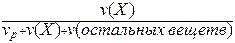 .
.
Массовая доля - безразмерная величина. Сумма мольных долей всех веществ в растворе = 1.
III. Масссовая концентрация (Т) - отношение массы компонента Х к объему раствора.
Т(Х) = 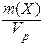 .
.
Обычно Т находят в единицах (г/дм3), в системе СИ она имеет единицы измерения (кг/м3). В аналитической химии эта величина находится в единицах (г/см3) и называется титром вещества Х.
IV. Молярная концентрация (молярность) С(Х) или [X] - отношение количества вещества к объему раствора.
С(Х) = [X] = 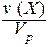 .
.
Обычно молярность выражают в (моль/дм3) и обозначают буквой (М). В системе СИ молярность должна иметь единицы измерения (моль/м3).
V. Моляльность (b) - отношение количества вещества Х к массе растворителя в данной порции раствора.
b(X) = 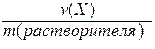 .
.
Моляльность может иметь только одну единицу измерения (моль/кг).
VI. Молярная концентрация эквивалента C(Э) - отношение количества вещества эквивалента к объему раствора:
C(Э) = C(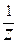 X) =
X) = 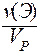 =
= 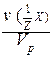 =
= 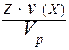 .
.
Ранее для обозначения этого понятия использовались синонимы: эквивалентная концентрация, нормальная концентрация, нормальность (все они считаются устаревшими).
Молярная концентрация эквивалентов обычно выражается в единицах (моль/дм3). В СИ она имеет единицы измерения (моль/м3).
Коллигативные свойства растворов
Некоторые физико-химические свойства разбавленных растворов не зависят от природы растворенного вещества, а определяются только количеством частиц этого вещества в растворе и природой растворителя. Такие свойства называются коллигативными.
Математические зависимости для коллигативных свойств выведены для сильно разбавленных растворов неэлектролитов. В случае электролитов в эти формулы вводится поправочный коэффициент, который называется изотоническим коэффициентом (i):
i = 1 - a (1 - n),
где a - степень электролитической диссоциации электролита; n - число ионов, на которые распадается каждая молекула электролита.
ОСМОС
В ходе экспериментальных исследований жидких растворов широко используются полупроницаемые перегородки (осмотические мембраны).
Осмотическая мембрана изготавливается из материала, который пропускает через себя только молекулы растворителя. Молекулы растворенного вещества не могут проходить через нее. В современных приборах по измерению осмотического давления (осмометрах) осмотические мембраны изготавливаются из специальных сортов целлофана.
Для объяснения явления осмоса рассмотрим схему (рис. 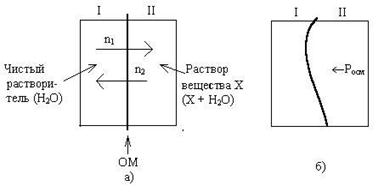 1а).
1а).
Некий сосуд разделен на две части осмотической мембраной (ОМ), выполненной из эластичного материала (типа очень тонкой резины). В начальный момент времени в левой части сосуда (I) находится чистый растворитель (например, вода), а в правой части сосуда (II) находится раствор вещества Х в данном растворителе (например, сахара в воде).
Концентрация молекул Н2О в чистом растворителе всегда больше, чем в растворе. Поэтому поток молекул воды через мембрану из левой части сосуда в правую (n1) будет больше, чем обратный поток (n2). Это приведет к тому, что объем I будет уменьшаться, а объем II увеличиваться. Эластичная осмотическая мембрана выгнется влево (рис. 1б).
Получается, что со стороны раствора на мембрану действует давление, которое деформирует эту перегородку. Такое давление называется осмотическим (Росм). Величина его определяется уравнением Вант-Гоффа:
Pосм = С(Х) × R × T,
где С(Х) - молярная концентрация вещества Х в растворе; R - универсальная газовая постоянная (8,31 Дж/моль×К); T - температура раствора (К).
Данное выражение по форме аналогично уравнению Менделеева - Клайперона для идеального газа:
P × V = 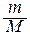 × R × T = v × R ×T,
× R × T = v × R ×T,
P = C × R × T.
Поэтому Вант-Гофф сформулировал закон осмотического давления следующим образом: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем при той же температуре.
Измерение осмотического давления - один из главнейших методов определения молярных масс высокомолекулярных веществ (каучук, целлюлоза, белки, жиры и т.п.).
ЗАКОН РАУЛЯ
Если жидкий летучий растворитель (например, воду) поместить в замкнутый объем, то через некоторое время установится равновесие (рис. 2).
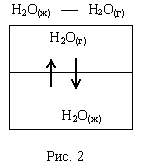
Равновесное давление паров воды (Р0) называется давлением насыщенного пара над чистым растворителем. Величина Р0 зависит только от природы растворителя (Н2О) и температуры. Если в воде при той же температуре растворить некоторое количество нелетучего вещества Х (например, сахара), то давление паров растворителя понизится на величину DР = Р0 - Р, где Р - давление паров растворителя над данным раствором. Величина 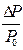 называется относительным понижением давления пара над раствором.
называется относительным понижением давления пара над раствором.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно мольной доле этого вещества в растворе.
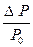 = x (X).
= x (X).
В экспериментальных исследованиях часто используются 2 следствия из закона Рауля.
Первое следствие из закона Рауля: раствор нелетучего вещества имеет температуру кипения выше, чем у чистого растворителя.
D Тк = Тр - Т0 = Кэ × b (X),
где D Тк - увеличение температуры кипения раствора по сравнению с чистым растворителем;
Тр - температура кипения раствора вещества Х;
T0 - температура кипения чистого растворителя;
b (X) - моляльность раствора (моль/кг растворителя);
Kэ - эбулиоскопическая константа.
Значение Кэ определяется только природой растворителя: для воды Кэ = 0,52 кг×К/моль, для бензола Кэ = 2,57 кг×К/моль, для этилового спирта Кэ = 1,16 кг×К/моль, для диэтилового эфира Кэ = 2,02 кг×К/моль и т.д.
Измерив температуру кипения раствора неизвестного вещества в данном растворителе, можно рассчитать его молярную массу. Этот метод называется эбулиоскопией.
Второе следствие из закона Рауля: раствор нелетучего вещества имеет температуру замерзания ниже, чем у чистого растворителя:
DTз = Т0 - Тр = Кк × b (X),
где D Тз - понижение температуры замерзания раствора по сравнению с чистым растворителем;
T0 - температура замерзания чистого растворителя;
Tр - температура замерзания раствора вещества Х;
b (X) - моляльность раствора (моль/кг растворителя).
Значение Кк для данного растворителя является константой:
Кк (Н2О) = 1,86 кг×К/моль, Кк (бензол) = 5,1 кг×К/моль,
Кк (диэтиловый эфир) = 1,73 кг×К/моль.
На этом следствии из закона Рауля основана криоскопия: метод нахождения молярных масс веществ, исходя из измерения температуры замерзания их растворов.
ТЕМА 6. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Вопросы программы:
1. Теория электролитической диссоциации.
2. Степень электролитической диссоциации. Сильные и слабые электролиты. Уравнения диссоциации.
3. Теория сильных электролитов. Кажущаяся степень электролитической диссоциации. Активность иона.
4. Теория слабых электролитов. Константа диссоциации. Закон разбавления Оствальда.
5. Ионные уравнения химических реакций.
6. Собственная диссоциация воды. Водородный и гидроксильный показатели.
7. Произведение растворимости. Ненасыщенный, насыщенный и пересыщенный раствор.
8. Гидролиз солей.
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Электролитическая диссоциация является следствием взаимодействия вещества с молекулами растворителя. В ходе этого процесса образуются ионы, окруженные молекулами растворителя - так называемой сольватной оболочкой (если растворителем является вода, оболочка называется гидратной). Ион вместе с сольватной оболочкой называется сольватированным (в случае воды - гидратированным или акватированным).
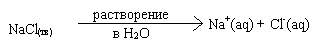
Индекс (aq) означает, что данный ион акватирован. Очень часто этот индекс опускается.
Основной количественной характеристикой процесса ЭД является степень электролитической диссоциации (точнее: истинная степень ЭД). Степень электролитической диссоциации (a) - это отношение числа молекул данного вещества, распавшихся на ионы (np) к общему числу молекул в данном растворе (n0):
a = 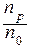 .
.
В соответствии со значениями a все вещества по отношению к данному растворителю можно разделить на 3 типа:
a = 0 неэлектролиты,
0 < a < 1 cлабые электролиты,
a = 1 cильные электролиты.
Сильные электролиты (уравнения диссоциации)
По современным представлениям, диссоциация сильного электролита является необратимым процессом (a = 1). В растворе сильного электролита нет его молекул, а есть только ионы, на которые он продиссоциировал. К сильным электролитам относятся:
1. Все соли. Соль диссоциирует как сильный электролит на кислотные остатки и основные остатки:
Fe2(SO4)3 = 2 Fe+3 + 3 SO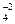 ,
,
NaHCO3 = Na+ + HCO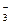 ,
,
AlOHCl2 = AlOH+2 + 2 Cl-.
2. Некоторые основания (они называются сильными основаниями или щелочами):
NaOH = Na+ + OH-,
Ba(OH)2 = Ba+2 + 2OH-.
3. Некоторые кислоты (они называются сильными кислотами):
HCl = H+ + Cl-,
HMnO4 = H+ + MnO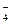 ,
,
H2SO4 = H+ + HSO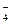 .
.
Слабые электролиты (уравнения диссоциации)
В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3 ¾ H+ + HCO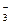 ,
,
HCO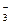 ¾ H+ + CO
¾ H+ + CO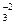 ,
,
CH3COOH ¾ CH3COO- + H+,
HSO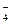 ¾ H+ + SO
¾ H+ + SO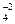 .
.
2. Многие основания (они называются слабыми) и все гидроксокатионы:
Fe(OH)2 ¾ FeOH+ + OH-,
FeOH+ ¾ Fe+ + OH-,
NH4OH ¾ NH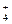 + OH-.
+ OH-.
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
Zn(OH)2 ¾ ZnOH+ + OH-,
ZnOH+ ¾ Zn+2 + OH-,
H2ZnO2 ¾ H+ + HZnO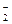 ,
,
HZnO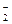 ¾ H+ + ZnO
¾ H+ + ZnO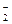 .
.
Теория сильных электролитов
По определению, для сильных электролитов истинная степень диссоциации a = 1. И, действительно, в их растворах не обнаружено целых (недиссоциированных) молекул.
Несмотря на это многие экспериментальные методы исследования степени диссоциации (самый простой основан на измерении электропроводности растворов) дают значения этой величины меньше 1.
Экспериментальное значение степени диссоциации сильного электролита называется кажущейся степенью ЭД (aк), причем всегда aк < a = 1 (a - истинная степень ЭД).
Кажущаяся степень ЭД зависит от концентрации сильного электролита в растворе (чем больше концентрация, тем меньше aк).
Несоответствие между a и aк объясняется взаимодействием сольватированных ионов электролита с образованием ионных пар.
Рассмотрим, например, явления происходящие в водном растворе хлорида натрия. Как и любой другой сильный электролит, твердый NaCl переходит в раствор только в виде ионов (Na+ и Cl-). Ионы эти гидратированы (окружены диполями молекул воды):
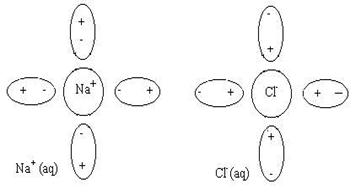
Внешняя поверхность гидратной оболочки имеет тот же по знаку заряд, что и центральный ион. Сольватированные катион и анион в результате столкновения друг с другом могут образовывать неустойчивую квазичастицу: Na+(aq) × Cl- (aq). Эта квазичастица называется ионной парой. Ионные пары довольно легко разрушаются при соударении с другими частицами. Описанные выше явления можно изобразить в виде схемы:
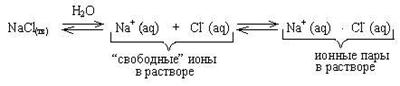
Если через раствор NaCl пропускать электрический ток, то ионные пары, как частицы в целом электронейтральные, не будут участвовать в электропроводности. Дальнейший расчет дает значение степени ЭД меньше 1. Понятно, что при увеличении концентрации увеличивается количество ионов в растворе, а значит усиливается ион-ионное взаимодействие с образованием ионных пар. Это приводит к уменьшению aк.
Во многих физических и химических процессах ионные пары ведут себя подобно “молекулам”, хотя, конечно, таковыми не являются. В ионной паре нет химической связи между центральными ионами, взаимодействуют только их гидратные оболочки.
Для учета отмеченных выше явлений вводится понятие об активности иона. Активность равна концентрации свободных ионов данного вида в растворе. Например, для ионов натрия:
a (Na+) = fa × [Na+],
где а (Na+) - активность ионов натрия;
fa - коэффициент активности ионов;
[Na+] - общая молярная концентрация ионов Na+ в растворе (как свободных, так и входящих в ионные пары).
Коэффициент активности (fa) показывает, какая часть ионов данного вида не входит в состав ионных пар, т.е. участвует в различных электрических и ионных процессах.
Для сильно разбавленных растворов коэффициент активности можно рассчитать. Сначала находится значение ионной силы раствора (J):
J = 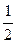 (
(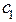
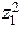 +
+ 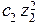 +....
+.... 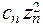 ),
),
где 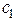 ,
, 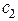 ....
.... 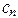 - молярные концентрации каждого из ионов в растворе;
- молярные концентрации каждого из ионов в растворе;
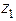 ,
, 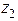 ....
.... 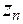 - их заряды.
- их заряды.
Коэффициент активности данного иона рассчитывается по уравнению:
lg fa = - 0,5 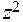
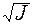 ,
,
где 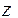 - заряд этого иона.
- заряд этого иона.
Теория слабых электролитов
Диссоциация любой частицы, являющейся слабым электролитом является обратимым процессом. Как и для любого другого обратимого процесса можно ввести понятие о константе равновесия, которая в данном случае получила название “константа диссоциации” (Кd). Например, угольная кислота является слабым электролитом и диссоциирует в две ступени (по второй ступени диссоциируют уже не молекулы Н2СО3, а гидрокарбонат-анионы НСО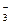 ):
):
1 cтупень: Н2СО3 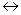 Н+ + НСО
Н+ + НСО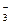
К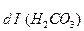 =
= 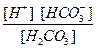
II ступень: HCO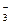
 ¾ H+ + CO
¾ H+ + CO
K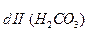 = Kd
= Kd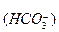 =
= 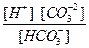
Общее уравнение: H2CO3 ¾ 2H+ + CO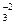
K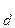 (общ) =
(общ) = 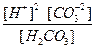 .
.
Нетрудно доказать, что:
К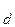 (общ) = К
(общ) = К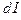 × K
× K или К
или К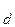 (общ) = К
(общ) = К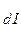 * K
* K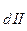 * K
* K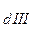 * K
* K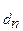 , где n - количество ступеней диссоциации слабого электролита.
, где n - количество ступеней диссоциации слабого электролита.
Используя принцип Ле-Шателье можно полагать, что К 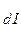 >> К
>> К 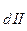 >> K
>> K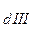 и т.д. И действительно для всех слабых электролитов найдено, что константы диссоциации по (n - I) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К
и т.д. И действительно для всех слабых электролитов найдено, что константы диссоциации по (n - I) - ой ступени на несколько порядков больше, чем таковая для n - ой ступени. Например, для угольной кислоты К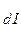 = 4,5 × 10-7, K
= 4,5 × 10-7, K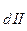 = 4,7 × 10-11.
= 4,7 × 10-11.
Величина константы диссоциации зависит только от природы элктролита и растворителя, а также от температуры. Значения К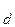 для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
для различных веществ при определенной температуре (как правило, 25 °С) приведены в специальных справочных таблицах.
Константа диссоциации не зависит от концентрации электролита в растворе, а степень диссоциации (a) слабого электролита имеет явную зависимость от этого параметра: чем больше концентрация, тем меньше (a). Функционально эта зависимость описывается законом разбавления Оствальда:
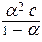 = K
= K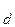 ,
,
где с - общая концентрация частиц электролита в растворе (моль/дм3);
K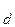 - константа диссоциации при данной температуре;
- константа диссоциации при данной температуре;
a - cтепень диссоциации.
В данном выражении независимой переменной является концентрация (С), а искомой величиной - a. Для решения этого уравнения его нужно преобразовать и решать относительно a как обычное квадратное уравнение:
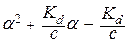 = 0.
= 0.
Положительным корнем этого уравнения является:
 a =
a = 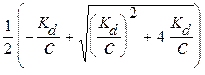 .
.
При решении многих задач предполагается, что a << 1 (a ® 0):
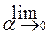
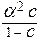 =
= 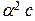 .
.
Поэтому во многих случаях можно использовать упрощенную формулу:
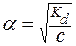 .
.
Она дает достаточно верный результат для значений a £0,1. Если же получается a > 0,1, то переходят к расчету по квадратному уравнению.
Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
HCl = H+ + Cl-,
NaOH = Na+ + OH-,
NaCl = Na+ + Cl-.
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O.
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
H+ + OH- = H2O.
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
Пример 1. CO2 + 2 NaOH = Na2CO3 + H2O
CO2 + 2Na+ + 2OH- = 2Na+ + CO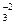 + 2H2O
+ 2H2O
CO2 + 2OH- = CO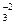 + 2H2O
+ 2H2O
Пример 2. 2AgNO3 + Na2S = Ag2S¯ + 2NaNO3
2Ag+ + 2NO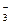 + 2Na+ + S-2 = Ag2S¯ + 2Na+ + 2NO
+ 2Na+ + S-2 = Ag2S¯ + 2Na+ + 2NO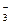
2Ag+ + S-2 = Ag2S¯
Пример 3. CaCO3¯ + 2HCl = CaCl2 + H2O + CO2
CaCO3 + 2H+ + 2Cl- = Ca+2 + 2Cl- + H2O + CO2
CaCO3 + 2H+ = Ca+2 + H2O + CO2
Пример 4. KHSO3 + KOH = K2SO3 + H2O
K+ + HSO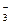 + K+ + OH- = 2K+ + SO
+ K+ + OH- = 2K+ + SO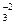 + H2O
+ H2O
HSO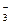 + OH- = SO
+ OH- = SO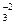 + H2O
+ H2O
Пример 5. NH4OH + HNO2 = NH4NO2 + H2O
NH4OH + HNO2 = NH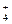 + NO
+ NO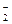 + H2O
+ H2O
Пример 6. CuCl2 + Zn = Cu + ZnCl2
Cu+2 + 2Cl- + Zn = Cu + Zn+2 + 2Cl-
Cu+2 + Zn = Cu + Zn+2
ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ
Вода является очень слабым электролитом. Она диссоциирует по уравнению:
H2O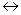 H+ + OH-.
H+ + OH-.
Для данного обратимого процесса можно написать выражение:
Kd (H2O) = 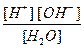 = 1,8 × 10-16 (при 22 °С).
= 1,8 × 10-16 (при 22 °С).
В данном выражении [H2O] равна концентрации молекул воды, не распавшихся на ионы. Так как на ионы распадается ничтожно малая часть молекул (a (H2O) = 1,8 × 10-7), то величину [H2O] можно считать постоянной и равной молярной концентрации чистой воды:
[H2O] = 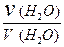 = 55,56 моль/дм3 = 55,56 М.
= 55,56 моль/дм3 = 55,56 М.
Полученное значение можно умножить на константу диссоциации и получить новую константу, которая называется константа воды (К):
K = [H2O] × Kd = 55,56 × 1,8 × 10-16» 1 × 10-14.
Константа воды определяет равновесные концентрации ионов Н+ и ОН- в водном растворе при данной температуре:
K = [H+] × [OH-] = 10-14 (при 22 °С).
Константа воды зависит только от природы воды и температуры. При охлаждении она уменьшается (К (5 °С) = 2,1 × 10-15), а при нагревании увеличивается (К (60 °С) = 1,3 × 10-13).
В чистой воде [H+] = [OH-] = 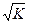 = 10-7 M. Такая среда называется нейтральной.
= 10-7 M. Такая среда называется нейтральной.
В водных растворах, содержащих кислоты [H+] > 10-7 M, а [OH-] < 10-7 M. Такая среда называется кислой. В растворах, содержащих основание [H+] < 10-7M, а [OH-] > 10-7M. Такая среда называется щелочной.
Для удобства пользуются не самими значениями концентраций ионов [H+] и [ОН-], а их отрицательными десятичными логарифмами, которые называются водородным показателем (рН) и гидроксильным показателем (рОН):
pH = - lg [H+],
pOH = - lg [OH-].
В нейтральной среде рН = 7.
В кислой среде рН < 7, pOH > 7.
В щелочной среде рН > 7, pOH < 7.
Если прологарифмировать уравнение [H+] [OH-] = 10-14, то можно показать, что рН + рОН = 14.
Характер среды в данном растворе можно качественно оценить с помощью специальных реактивов, которые называются кислотно-основными индикаторами. Примером такого индикатора являются лакмус: при рН < 5 он имеет красный цвет, в интервале 5 £ рН £ 8 - фиолетовый цвет, а при рН > 8 - синий цвет.
Точное определение рН (или рОН) растворов осуществляется специальными приборами (рН- метрами).
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Произведение растворимости (ПР) является частным случаем константы равновесия для процесса перехода труднорастворимого сильного электролита в раствор.
Рассмотрим пример: в емкость с водой поместили кристаллический хлорид серебра (AgCl). Абсолютно нерастворимых веществ в природе не существует. Поэтому, несмотря на очень плохую растворимость, хлорид серебра начинает переходить в воду, причем в виде ионов Ag+ и Cl- (т.к. любая соль - сильный электролит). Растворение AgCl будет происходить до тех пор, пока не установится равновесие:
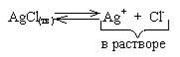
После установления такого равновесия раствор будет называться насыщенным. Для данного обратимого процесса можно ввести константу равновесия:
Kp = 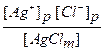 ,
,
где [Ag+]p и [Cl-]p - молярные концентрации соответствующих ионов в равновесном (насыщенном) растворе.
Концентрация [AgCl m ] является постоянной величиной. По сути дела это плотность твердого хлорида серебра, выраженная в единицах молярной концентрации (моль / дм3 = М). Поэтому вводится новая константа равновесия, которая называется произведением растворимости (ПР):
ПР(AgCl) = Kp × [ AgCl(m) ] = [Ag+]p × [Cl-]p.
ПР зависит только от природы веществ (электролита и воды) и температуры. ПР определяет произведение концентраций в насыщенном растворе. Если в каком-либо растворе произведение концентраций ПК = [Ag+] [Cl-] меньше ПР, то такой раствор является ненасыщенным. В нем можно растворить еще некоторое количество данного вещества (до насыщения: ПК = ПР).
Если же ПК > ПР, то раствор называется пересыщенным. Это тоже неравновесный раствор, так как избыточное количество растворенного вещества будет самопроизвольно выпадать в виде осадка до тех пор, пока ПК не станет равным ПР при этой температуре.
Задача. Выпадет ли осадок, если смешать 1 дм3 раствора AgNO3 с концентрацией 0,01 М и 1 дм3 раствора K2SO4 с концентрацией 0,2 M? ПР (Ag2SO4) = 2 × 10-5?
Решение: Взаимодействие должно протекать по уравнению:
2AgNO3 + K2SO4 = Ag2SO4¯ + 2KNO3.
Но осадок сульфата серебра начнет выпадать только при: ПК = [Ag+]2 [SO4]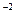 > ПР = 2 × 10-5. Найдем [Ag+]. В 1 дм3 исходного раствора AgNO3 содержалось 0,01 моль соли, а значит и 0,01 моль Ag+, так как AgNO3 - сильный электролит и диссоциирует полностью:
> ПР = 2 × 10-5. Найдем [Ag+]. В 1 дм3 исходного раствора AgNO3 содержалось 0,01 моль соли, а значит и 0,01 моль Ag+, так как AgNO3 - сильный электролит и диссоциирует полностью:
AgNO3 = Ag+ + NO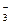
0,01 моль 0,01 моль 0,01 моль
Так как растворы очень разбавлены, то сумма их объемов равна объему смеси (1 дм3 + 1 дм3 = 2 дм3).
Отсюда [Ag+] = 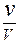 = 0,01 моль/2 дм3 = 0,005 М (после смешивания).
= 0,01 моль/2 дм3 = 0,005 М (после смешивания).
Аналогично можно найти концентрацию ионов SO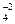 в смеси:
в смеси:
[SO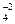 ] = 0,2 моль/2 дм3 = 0,1 М.
] = 0,2 моль/2 дм3 = 0,1 М.
Найдем ПК = [Ag+]2 [SO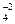 ] = (5 × 10-1) = 2,5 × 10-6,
] = (5 × 10-1) = 2,5 × 10-6,
2,5 × 10-6 = ПК < ПР = 2 × 10-5.
Ответ: осадок выпадать не будет.
ГИДРОЛИЗ СОЛЕЙ
Гидролиз - это обменное взаимодействие между частицами вещества, растворенного в воде и молекулами растворителя (воды).
Гидролизу могут подвергаться как органические, так и неорганические вещества. Наиб
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 4872; Нарушение авторских прав?; Мы поможем в написании вашей работы!