
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Координационная теория Вернера
|
|
|
|
По Вернеру формулу комплексного соединения можно разбить на две части: внутреннюю сферу и внешнюю сферу.
Внутренняя сфера (синонимы: комплексная частица, комплекс) состоит из центрального атома или иона (комплексообразователь) и частиц, окружающих комплексообразователь (лиганды). В формуле вещества комплекс выделяется квадратными скобками. Во внешнюю сферу входят обычные ионы, которые компенсируют общий заряд комплекса. Если комплекс имеет нулевой заряд, то внешняя сфера в соединении отсутствует.
Пример 1. [Zn+2(NH3) ]+2(OH)
]+2(OH)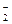
комплекс [Zn(NH3)4]+2
комплексообразователь Zn+2
лиганды NH3
внешняя сфера ионы ОH-.
Пример 2. K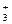 [Fe+3 (CN)
[Fe+3 (CN) ]-3
]-3
комплекс [Fe(CN)6]-3
комплексообразователь Fe+3
лиганды CN-
внешняя сфера ионы К+.
Пример 3. [Pt+2(NH3)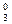 Cl
Cl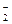 ]0
]0
комплекс [Pt (NH3)2Cl2]
комплесообразователь Pt+2
лиганды NH3 и Cl-
внешняя сфера отсутствует.
Пример 4. [Fe0(CO)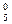 ]
]
комплекс [Fe(CO)5]
комплексообразователь атом Fe
лиганды СО (молекулы)
внешняя сфера отсутствует.
В большинстве комплексных соединений в качестве комплексообразователей выступают ионы или атомы d- и f- металлов. Значительно реже - катионы р - элементов (в основном р - металлов). Для комплексообразователя вводится понятие о координационном числе (КЧ). КЧ равно числу s - связей между комплексообразователем и лигандами в комплексе. В настоящее время обнаружены следующие КЧ = 1, 2, 3, 4, 5, 6, 7, 8, 9 и 12. Чаще всего встречается КЧ= 6, 4 и 2.
Как правило, один и тот же комплексообразователь в своих комплексах может проявлять различные координационные числа. Так, например, ион Со+2 в одних комплексах имеет КЧ=4 [CoCl4]-2, а в других - КЧ=6 [Co(H2O)6]+2.
КЧ является понятием аналогичным валентности, поэтому раньше для КЧ использовался синоним: “координационная валентность”.
В качестве лигандов в комплексе могут выступать как различные анионы (F-; Cl-; Br-; J-; OH-; CN-; CNS-; NO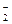 ; SO
; SO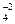 и т.д.), так и некоторые молекулы (NH3; H2O; CO; NO; Cl2 и т.д.). Лиганды характеризуются координационной емкостью (дентантность), равной числу s - связей, которыми данный лиганд соединен с комплексообразователем. Известны лиганды с дентантностью 1(монодентантные), 2 (бидентантные), 3 (тридентантные), 4 (тетрадентантные), 6 (гексадентантные). Лиганды с дентантностью 2, 3, 4 и 6 называются полидентантными. Подавляющее большинство лигандов - монодентантны (образуют одну связь с комплексообразователем): H2O; NH3; OH-; F-; Cl-; Br-; J- и т.д. Полидентантных лигандов значительно меньше. Например, бидентантными лигандами являются оксалат-анионы С2О
и т.д.), так и некоторые молекулы (NH3; H2O; CO; NO; Cl2 и т.д.). Лиганды характеризуются координационной емкостью (дентантность), равной числу s - связей, которыми данный лиганд соединен с комплексообразователем. Известны лиганды с дентантностью 1(монодентантные), 2 (бидентантные), 3 (тридентантные), 4 (тетрадентантные), 6 (гексадентантные). Лиганды с дентантностью 2, 3, 4 и 6 называются полидентантными. Подавляющее большинство лигандов - монодентантны (образуют одну связь с комплексообразователем): H2O; NH3; OH-; F-; Cl-; Br-; J- и т.д. Полидентантных лигандов значительно меньше. Например, бидентантными лигандами являются оксалат-анионы С2О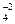 (это кислотный остаток щавелевой кислоты), SO
(это кислотный остаток щавелевой кислоты), SO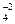 ; CO
; CO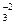 . Причем, ионы SO
. Причем, ионы SO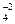 и СО
и СО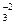 в некоторых комплексах являются монодентантными.
в некоторых комплексах являются монодентантными.
Пример. Ион Со+3 образует комплексы
[Co(NH3)4SO4]+ и [Co(NH3)5SO4]+.
В этих комплексах КЧ (Со+3)= 6.
Дентантность лиганда NH3 всегда равна 1, поэтому ион SO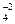 в первом комплексе бидентантен, а во втором - монодентантен.
в первом комплексе бидентантен, а во втором - монодентантен.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 594; Нарушение авторских прав?; Мы поможем в написании вашей работы!