
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Давление. ОСМОС. Законы Вант-Гоффа и Рауля
|
|
|
|
ОСМОС – явление, обусловленное переносом растворителя через полупроницаемую мембрану или процесс диффузии растворителя из менее концентрированного раствора в более концентрированный раствор.
Закон Вант-Гоффа - закон осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества. Выводится из ур-ия Менделеева-Клапейрона:
PV= νRT à заменим Р на p (осмотическое давление) и ν/V=C à [ p = CRT]
Обратный осмос: если на раствор с большей концентрацией воздействует внешнее давление, превышающее осмотическое, молекулы воды начнут двигаться через полупроницаемую мембрану.
Закон Генри: Растворимость газа при постоянной температуре прямо пропорциональна его парциальному давлению над раствором. Cмасс. = К ∙ Р, где К – константа Генри, Р – парциальное давление. Повышение давления приводит к пропорциональному росту растворимости газа.
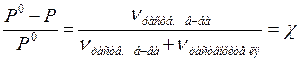 Давление насыщенного пара растворителя над раствором:
Давление насыщенного пара растворителя над раствором:
I закон Рауля: Относительное понижение давления
насыщенного пара растворителя над раствором равно
мольной доле растворенного вещества.
Р0 – давление насыщенного пара над растворителем, Р – давление насыщенного пара растворителя над раствором, c = мольная доля растворенного вещества в растворе.

| II закон Рауля: Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. |
m, g – массы растворенного вещества и раствора, [г], M – молярная масса растворенного вещества [г/моль], Ккип. – эбулиоскопическая константа (молярное повышение температуры кипения.) 0С
III закон Рауля: Понижение температуры замерзания раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества .(формула та же почти)
t (кип. р-ра) = t (кип. р-ля) + D t(кип.) = t (кип. р-ля) + К кип.∙ С
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 916; Нарушение авторских прав?; Мы поможем в написании вашей работы!