
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз. гидролиз солей
|
|
|
|
Гидролиз – процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие воды и меняется рН среды.Гидролиз является частным случаем реакций сольволиза, т. е. реакций обмена между растворителем и растворенным веществом.
Гидролизу подвергаются: соли, углеводы, белки, мыла, сложные эфиры, жиры, Феноляты, алкоголяты, галогенангидриды и другие вещества.
Соли могут быть образованы: Сильным основанием + сильной кислотой (Na2SO4); сильным основанием + слабой кислотой (Na2CO3); слабым основанием + сильной кислотой (NH4)2SO4
слабым основанием + слабой кислотой (NH4)2CO3;
Гидролизу подвергаются только те соли, в состав которых входит ион от слабого электролита. Ион слабого электролита – двигатель гидролиза. Соли, образованные сильным основанием сильной кислотой гидролизу не подвергаются. Обычно гидролиз идет незначительно и преимущественно по первой ступени (один ион слабого электролита взаимодействует только с одной молекулой воды).
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью.
Реакцию среды при гидролизе определяется по виду иона сильного электролита: соль сильного основания – среда щелочная, соль сильной кислоты – среда кислая.
2Na+ + CO32- +HOH D HCO3- + 2Na+ + OH- (щелоч. среда); Na2CO3 + Н2О D NaНСО3 + NaOH;
Cu2+ + 2NO3 -+ HOH D (CuOH)+ + H+ + 2NO3- (кислая) Сu(NO3)2 + Н2О D СuOHNO3 + HNO3;
Cr2S3 + 6Н2О D 2 Cr(OH)3 + 3H2S (Среда близка к нейтральной рН ≈ 7)
Ступенчатый гидролиз:
I ступень: Na2CO3 + Н2О D NaНСО3 + NaOH; II ступень: NaНСО3+ Н2О D NaOH + H2CO3
Гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований по второй и третьей ступеням протекает незначительно.
Факторы, влияющие на процесс гидролиза: природа гидролизующегося вещества ( чем слабее электролит, образовавший соль, тем активнее происходит процесс гидролиза); концентрация
|
|
|
(разбавление раствора способствует гидролизу); температура (повышение температуры усиливает гидролиз). Пример: гидролиз раствора ацетата натрия CH3COONa:
CH3COONa + HOH→ CH3COOH + NaOH; CH3COO- + Na+ + HOH→ CH3COOH + Na+ + OH-
CH3COO- + HOH→ CH3COOH + OH- (pH >7) Среда – слабощелочная.
Cтепень гидролиза 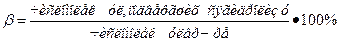 ;
;
Константа гидролиза К гидр 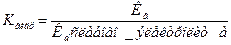 ;
; 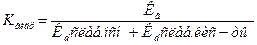
Для соли слабого основания и слабой кислоты – вторая ф-ла.
Произведение растворимости: В н асыщенном растворе труднорастворимого сильного электролита произведение концентраций его ионов в степенях их стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР), к-рое характеризует растворимость (S) труднорастворимого электролита при данной температуре:
s s s
CaSO4 D Ca2+ + SO42-, ПР(CaSO4) = [Ca2+] ∙[SO42-] = S^2 = 2,5∙10 –5; S = √2,5∙10 –5 = 5∙ 10 -3 [моль/л]
Из двух однотипных солей большей растворимостью обладает та соль, у которой ПР больше, например: S (BaSO4) < S (CaSO4).
Условие образования и растворения осадков:
ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Сравним ПК и ПР:
Если ПК = ПР, Δ G = 0 – система находится в состоянии равновесия (раствор насыщенный).
Если ПК < ПР, Δ G < 0 – самопроизвольно протекает процесс растворения осадка (раствор ненасыщенный).
Если ПК > ПР, Δ G > 0 – возможен обратный процесс – выпадание осадка (раствор пересыщенный).
S 2S S
Ag2SO4 D2Ag+ +SO42-; ПР (Ag2SO4) D[Ag+]2 ∙ [SO42-] =2S^2 ∙S = 4S^3 = 2 ∙ 10 -5: S = 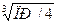
Если в насыщенный раствор электролита ввести некоторое количество одноименных ионов, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть от введения в раствор одноименных ионов растворимость электролита понижается.
|
|
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1094; Нарушение авторских прав?; Мы поможем в написании вашей работы!