
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
Влияние реакции среды на протекание ОВР
ОВР (окислительно-восстановительные реакции)
Химические реакции: протекающие без изменения степени окисления NaOH+HCl = NaCl+H2O;
Окислительно-восстановительные реакции (Zn0+2H+Cl = Zn+2Cl2+H20↑)
Окислительно-восстановительные реакции -это реакции, протекающие с изменением степени окисления атомов, входящих в состав молекул реагирующих веществ. Cтепень окисления -это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.
[исключения: в гидридах cтепень окисления атомов водорода равна –1. Например: CaH2-1, NaH-1;
степень окисления кислорода во фториде кислорода (OF2) равна +2, в пероксидах (Н2О2, Na2O2) степень окисления кислорода равна –1.]
Окисление – это процесс отдачи электронов атомом, молекулой или ионом, при этом степень окисления повышается, а вещество является восстановителем. Na0 – 1e- → Na+1 (процесс окисления)
Восстановление – это процесс присоединения электронов, при этом степень окисления понижается, а вещество является окислителем .Cl0 + 1e- → Cl-1 (процесс восстановления). Окислитель - вещество, которое принимает электроны. При этом оно восстанавливается (степень окисления элемента понижается). Восстановитель – вещество, которое отдает электроны. При этом оно окисляется (степень окисления элемента понижается).
Окислители: галогены (F2, CI2, Br2, J2), халькогены (О2, О3, S); HNO3, H2SO4, K2MnO4, K2Cr2O7, K2CrO4, MnO2, PbO2,KCIO3; Восстановители: металлы (Na, Mg, Zn, Al, Fe); неметаллы (Н2, С, S); H 2S и сульфиды (Na2S); сульфиты (Na2SO3); галогеноводороды (HCI, HBr, HJ).
Классификация ОВР
¡ 1.Реакции межмолекулярного окисления – восстановления: окислитель и восстановитель входят в состав различных молекул. С + 2CuO = CO2 + 2Сu0 (С –восст-ель, Сu-ок-ие)
¡ 2.Реакции внутримолекулярного окисления – восстановления: окислитель и восстановитель входят в состав одной молекулы (и представлены разными элементами, либо одним элементом, но с разными степенями окисления) 2 KCIO3 = KCI + 3O2 (Cl –ок-ель, О-восст-ель), NH4NO2 = N2 + 2H2O;
¡ 3.Реакции самоокисления –самовосстановления (диспропорционирования): при протекании этих реакций происходит и повышение и понижение степени окисления одного и того же элемента.
Например:CI20 + H2O = HCI-1 + HCI+1O; Cl0 +1e → Cl- восстановление, окислитель
¡ Cl0 - 1e → Cl+ окисление, восстановитель
(NH4)2Cr2O7 → t Cr203 + N2 + 4H2O
КMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O (зеленый)
КMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH (бурый)
КMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + H2O (бесцветный)
КОРРОЗИЯ – процесс разрушения металлов под действием окружающей среды вследствие протекания окислительно-восстановительных реакций.
Химическая коррозия: характеризуется непосредственным переходом электронов от окислителя к восстановителю при их непосредственном контакте.Zn + S = ZnS; Zn0 - 2e → Zn+2 окисление
S0 + 2e → S-2 восстановление
Электрохимическая коррозия: характеризуется пространственным разделением процессов окисления (протекают на анодных участках) и процессов восстановления (протекают на катодных участках).
По виду коррозионной среды коррозия: газовая, атмосферная, почвенная (подземная), жидкостная (пресноводная, морская, в химических агрессивных средах).
По характеру разрушения коррозия: местная, общая (равномерная, неравномерная).
Местная коррозия: пятнами, язвами, точками, межкристаллитная, избирательная, подповерхностная.
Виды коррозионно-механических повреждений: водородная хрупкость, коррозионное растрескивание (сульфидное растрескивание), коррозионная усталость, коррозионный износ (фреттинг), коррозионная кавитация.
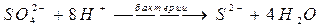 Микробиологическая коррозия: - коррозия под действием микроорганизмов: в аэробных условиях (с кислородом), в анаэробных условиях (без кислорода). Действие сульфатовосстанавливающих бактерий:
Микробиологическая коррозия: - коррозия под действием микроорганизмов: в аэробных условиях (с кислородом), в анаэробных условиях (без кислорода). Действие сульфатовосстанавливающих бактерий:
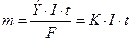 Коррозия под действием блуждающих токов: По закону Фарадея ток силой
Коррозия под действием блуждающих токов: По закону Фарадея ток силой
1 ампер за 1 год разрушает: Fe - 9 кг, Zn - 11кг, Pb - 34 кг
Виды гальванических элементов: а) макрогальванический, б) короткозамкнутый,
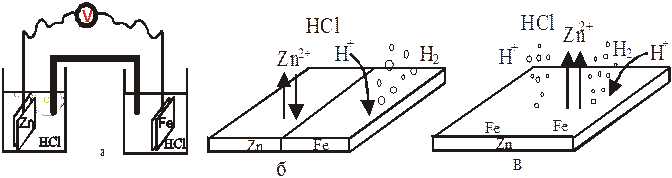 в) микрогальванический микрогальванический
в) микрогальванический микрогальванический
Причины электрохимической гетерогенности поверхности металла:
· Сочетание в конструкции металлов с различными величинами электродных потенциалов. Металл с меньшей величиной потенциала выполняет функции анода, возникающего при этом макрогальванического элемента.
· Наличие в металле неметаллических примесей и включений, выполняющих функцию катодов возникающего микро-гальванического элемента.
· Различие химического состава электролита у отдельных участков поверхности металлической конструкции (концентрационный гальванический элемент).
· Различный доступ окислителя к поверхности металла. Участки, к которым доступ окислителя, например, кислорода затруднен являются анодами возникающего при этом элемента дифференциальной аэрации.
· Резкие перепады температуры в пределах металлической конструкции. Более нагретые участки обычно являются анодами возникающего в этом случае термогальванического элемента.
· Наличие на поверхности металла участков с нарушенной окисной пленкой, обнаженный участок при этом является анодом.
· Наличие на поверхности металлов местных деформированных участков, окалины, биоотложений, слоев сульфидов и др.
· Неравномерное наложение внешнего электрического поля (электрокоррозия, коррозия под действием блуждающих токов).
.:::Защита металлов от коррозии
| Осн. антикоррозионные мероприятия 1. Рациональное конструирование 2. Выбор устойчивых к коррозии конструкционных материалов | 3. Химическая обработка среды 4. Применение защитных покрытий 5. Электрохимическая защита |
| Химическая обработка среды: | |||
| Удаление деполяризатора | |||
| 1) кислород(нейтральная или щелочная среда) · КипячениеПропускание через поглощающие кислород фильтры · Обработка сульфитами 2NaSO3+O2=2Na2SO4 · Обработка гидразином N2H2+O2=N2+2H2O | б) ионы водорода (кислая среда) · Нейтрализация растворами щелочей (NaOH, Ca(OH)2) · Обработка растворами гидролизующихся по аниону солей (карбонат натрия, фосфат натрия) | ||
| Удаление солей | Удаление кислых газов (H2S, CO2) | ||
| · дистилляция · ионный обмен · обратный осмос | · Нейтрализация щелочными реагентами: H2S + 2NaOH → Na2S + 2H2O; CO2 + Ca(OH)2 → CaCO3↓ + H2O · Осаждение в виде малорастворимых соединений (сульфидов, карбонатов) H2S + CuSO4 → CuS↓ + 2H2SO4 · Окисление сероводорода сильными ок-лями (KMnO4, K2Cr2O7) S-2 -2e→ So | ||
| Применение ингибиторов коррозии (в-в, тормозящих скорость коррозионного процесса): Ингибиторы: неорганические (хроматы, нитраты, фосфаты, силикаты), органические (амины, амиды, четвертичные аммониевые соли) По мех-му действия: Анодные ингибиторы тормозят процесс перехода ионов металла в раствор; Катодные ингибиторы тормозят процесс деполяризации; Ингибиторы экранирующего действия осуществляют смешанный контроль. (ПАВ)- эффективные ингибиторы коррозии | |||
4.Применение защитных покрытий (металлических, неметаллических, химических)
Металлические защитные покрытия: Хромирование, Никелирование, Алитирование, Меднение Серебрение, Золочение, Кадмирование, Цинкование, Лужение (Sn). Способы нанесения металлических защитных и декоративных покрытий: металлизация, плакирование, электролиз
Катодные покрытия - покрытия менее активным металлами, Анодные покрытия - покрытия более активными металлами.
Мех-м действия катодного металлич.покрытия:Коррозия луженого железа в кислой среде:
φ0(Fe)= - 0,44 B, φ0(Sn)= -0,136 B
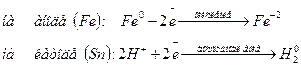 Железо-анод, Олово- катод Железо-анод, Олово- катод
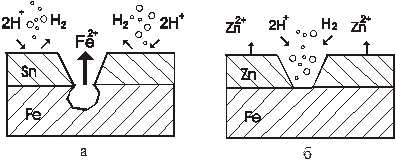
| Мех-м действия анодного металлич. Покрытия:
Коррозия оцинкованного железа
φ(Fe)= - 0,44 B, φ(zn)= -0,76 B
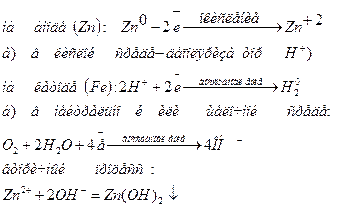 Fe-катод, Zn- анод Fe-катод, Zn- анод
|
Химические защитные покрытия: Оксидирование, Фосфатирование
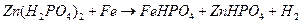 Электрохимическая защита: протекторная, катодная
Электрохимическая защита: протекторная, катодная
Протекторная защита - осуществляется соединением защищаемой конструкции с более активным металлом, выполняющим функцию «жертвенного анода» (протектора). Для реализации протекторной защиты необходимо протектор плотно закрепить на чистой поверхности защищаемого металла. Если на эту конструкцию будет воздействовать влага, то электроны протектора будут переходить в защищаемый металл и на катоде начнется выделение водорода. Ионы протектора, соединяясь с кислородом (гидроксильными группами ОН), вызывают окислительную реакцию, которая приводит к появлению гидроокиси того металла, из которого сделан протектор. Таким образом обеспечивается катодная защита пока протектор полностью не разрушится вследствие коррозии.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 748; Нарушение авторских прав?; Мы поможем в написании вашей работы!