
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процессы при электролизе
|
|
|
|
l направленное движение ионов электролита к электродам: положительно заряженные ионы (катионы) перемещаются к катоду, отрицательно заряженные анионы – к аноду
l окислительно-восстановительные процессы на электродах. при электролизе, как при любой электрохимической реакции, на аноде протекает процесс окисления, т.е. процесс отдачи электронов, а на катоде - процесс восстановления, т.е. процесс присоединения электронов
l образовавшиеся на электродах вещества (ионы или нейтральные молекулы)могут покидать поверхность электродов, кроме того, они могут вступать во вторичные взаимодействия.
В первую очередь, должны окисляться наиболее сильные восстановители – вещества, имеющие наиболее отрицательное значение электродных (окислительно– восстановительных) потенциалов. Впервую очередь, восстанавливаются наиболее сильные окислители, имеющие наибольшие положительные значения электродных (окислительно–восстановительных) потенциалов.
На катоде:
В первую очередь восстанавливаются катионы малоактивных металлов, расположенных в ряду стандартных электродных потенциалов после водорода.
Катионы металлов средней активности, стоящие в ряду между Аl и Н2, восстанавливаются совместно с катионами водорода (из молекул Н2О). При этом на катоде одновременно протекают два процесса:
а) Процесс восстановления ионов металла средней активности: Me+n + ne = Me0
б) процесс восстановления ионов водорода из воды: 2H2О + 2e = Н2 + 2ОН –
Катионы активных металлов от Li до Аl (включительно) при электролизе водных растворов не восстанавливаются. На катоде в этом случае восстанавливаются только ионы водорода из воды и выделяется водород из воды: 2H2О + 2e = Н2 + 2ОН –
При электролизе растворов сильных кислот, характеризующихся высокими концентрациями ионов водорода, на катоде восстанавливаются ионы водорода Н +: 2H + + 2e = Н20
На аноде:
Если анод нерастворимый (инертный), то в первую очередь на нем окисляются анионы бескислородных кислот (за исключением ионов фтора F -)2Сl – – 2e = Cl2
Анионы кислородсодержащих кислот (оксокислот), например, SO4 2–, NO3 –, СО3 2–, РO4 3–, а также фторид ион (F –), не окисляются при электролизе водных растворов. При этом на аноде идет процесс окисления молекул Н2О: 2H2О – 4e = O2 + 4H +
При электролизе растворов щелочей на аноде окисляются ионы ОН –: 4ОН – – 4e = 2O2 + 2 H2O
Возможные процессы на аноде:
-окисление анионов кислотных остатков 2Сl - - 2e = Cl2 процесс 1
-окисление анионов гидроксила 4ОН - - 4e = 2O2 + 2 H2O процесс 2
-окисление молекул воды 2H2О - 4e = O2 + 4H + процесс 3
-окисление материала анода Me 0 - ne = Me +n процесс 4
Возможные процессы на катоде: ( не зависят от материала катода, а зависят от положения металла в ряду стандартных электродных потенциалов)
-восстановление катионов металла Me +n + ne = Me 0 процесс 5
-восстановление ионов водорода 2H + + 2e = Н2 процесс 6
-восстановление молекул воды 2H2O + 2e = Н2 + 2ОН – процесс 7
Электроды: инертные и активные
Электрод (анод), материал которого может окисляться в процессе электролиза, называется активным (растворимым) электродом. Не окисляющийся в процессе электролиза и служащий только для подвода электрического тока электрод называется инертным.
Первый закон Фарадея. Масса вещества, выделяющегося на электроде при электролизе, пропорциональна количеству прошедшего через раствор электричества. m = k · Q, где
k - коэффициент пропорциональности (электрохимиический эквивалент) (г/Кл);Q - количество электричества(Кл). Q = I · t; k=M(экв)/F, гдеF= 96500 Кл/моль - постоянная Фарадея
.::Электрохимия
Возникновение скачка потенциала на границе раздела металл - водный раствор электролита
Равновесие в растворе: Ме + H2O D Me+n ∙ mH2O + ne-
Потенциал, возникающий на поверхности металла при погружении его в какой – либо раствор называется электродным потенциалом металла. Е, ε, φ Размерность – вольт - [В]
Величина электродного потенциала – мера электрохимической активности металла.
Направление перехода катионов металла в жидкую фазу:
Направление перехода определяется двумя факторами: Ме + H2O D Me+n ∙ mH2O + ne-
· средней энергией катионов в металле Ет (зависит только от природы металла)
· средней энергией катионов в растворе Еж (зависит от природы металла, концентрации (активности) катионов в растворе и от природы растворителя)
Если Ет > Еж - катионы преимущественно переходят из твердой фазы в жидкую. При этом Ме заряжается отрицат., а р-р - положит. Если Ет < Еж - катионы преимущественно переходят из жидкой фазы в твердую. При этом металл заряж. Положит., а р-р - отрицательно. Если Ет = Еж - преимущественный переход катионов из одной фазы в другую отсутствует и на границе фаз устанавливается равновесие.
Измерение величины электродного потенциала: абсолютную величину электродного потенциала измерить невозможно; относительную величину электродного потенциала измеряют при сравнении его с потенциалом электрода, выбранного в качестве эталона. При этом составляется гальванический элемент. В качестве электрода сравнения часто используют стандартный водородный электрод.
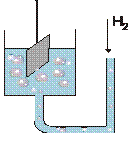 Устройство водородного электрода
Устройство водородного электрода
¡ 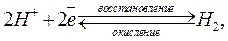 Условная запись: Pt,H2 / H2SO4; Равновесие на водородном электроде:
Условная запись: Pt,H2 / H2SO4; Равновесие на водородном электроде:
àPt Потенциал водородного электрода зависит:
Р-р кис-тыà от давления газообразного водорода; от концентрации ионов водорода в
растворе кислоты; от температуры. Устройство водородного электрода: 1-
проводник к измерительному устройству; 2-корпус электрода; 3-платиновая пластина, покрытая слоем губчатой платины (“платиновой чернью”); 4-трубка для подачи газообразного водорода; 5-р-р кислоты;6-электролитический ключ. Водородный электрод, находящийся при стандартных условиях: [ Н+] = 1 моль/л, Р = 101,3 кПа, Т = 298 К, называют стандартным водородным электродом. Потенциал такого электрода условно принят за 0 при любой температуре.
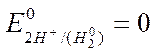 Стандартным электродным потенциалом металла называется
Стандартным электродным потенциалом металла называется
равновесный потенциал металла, находящегося в контакте с
раствором собственной соли при стандартных условиях ([Men+] = I моль/л, Т=298К) и измеренный относительно стандартного водородного электрода.
Для определения стандартного электродного потенциала меди составляют гальванический элемент, состоящий из медного электрода и стандартного водородного электрода. Условная запись этого элемента: Анод (-)Pt/H2/H2SO4//CuSO4/Cu(+) Катод; Определение стандартного электродного потенциала цинка: условная запись: Анод(-)Zn/ZnSO4//H2SO4/H2,Pt(+)Катод
Располагая Ме в порядке возрастания величин их стандартных электродных потенциалов, можно получить ряд, называемый рядом стандартных электродных потенциалов. Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Ca, Ni, Sn, Pb, H, Sb, Bi, Cu, Ag, Hg, Pd, Pt, Au. Чем левее в ряду находится металл и чем меньше величина его электродного потенциала, тем он химически активнее, тем легче металл окисляется, но тем труднее восстанавливаются его ионы. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют (восстанавливают) его из разбавленных кислот (типа серной или соляной, анионы которых не проявляют окислительных свойств), а стоящие правее водорода, его не вытесняют. Zn + H2SO4 → ZnSO4 + H2↑ Наиболее активные металлы, стоящие в ряду до Mg, вытесняют водород даже из воды. Каждый металл этого ряда, не разлагающий воду, вытесняет (восстанавливает) следующие за ним металлы из растворов их солей.Чем дальше расположены металлы в ряду друг от друга, тем большую Э.Д.С. будет иметь составленный из них гальванический элемент
.::Понятие о гальваническом элементе
Для практического определения величины электродного потенциала составляют гальванический элемент. Гальванический элемент – это устройство, состоящее, как минимум, из двух электродов (полуэлементов), в котором химическая энергия превращается в электрическую.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 3488; Нарушение авторских прав?; Мы поможем в написании вашей работы!