
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химических реакций в стандартных условиях
|
|
|
|
Закон Гесса и следствия из него. Расчет тепловых эффектов
Многие химические реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния:
Q V = D U,
Q p = D H.
Эти равенства в применении к химическим реакциям составляют суть закона Гесса, открытого в 1836 г. русским химиком Г.И. Гессом:
Тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется только н6ачальным и конечным состоянием системы при следующих условиях:
1) процесс осуществляется при V = const или p = const;
2) температура исходного и конечного состояний системы одинакова (однако это не означает, что она должна быть постоянной в течение всего процесса);
3) единственным видом работы является работа расширения (сжатия).
Если не выполняется хотя бы одно из условий, закон Гесса не работает.
 Действие закона Гесса удобно представить в виде схемы. Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ в продукты реакции, который может быть осуществлен различными путями в одну или несколько стадий (рис. 1).
Действие закона Гесса удобно представить в виде схемы. Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ в продукты реакции, который может быть осуществлен различными путями в одну или несколько стадий (рис. 1).
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны между собой соотношением:
D Н 1 = D Н 2 + D Н 3 + D Н 4 = D Н 5 + D Н 6.
Тепловой эффект изобарного процесса часто называют просто энтальпией.
Уравнение реакции с указанием агрегатного состояния реагентов и теплового эффекта реакции называют термохимическим уравнением. Например, термохимическое уравнение реакции образования бензола в жидком состоянии из простых веществ запишется:
6С (т) + 3Н2 (г) = С6Н6 (ж), D Н ° = 49,03 кДж/моль,
где символы (т), (ж), (г) указывают на агрегатное состояние реагента. Эти символы обычно опускаются, когда агрегатное состояние вещества является очевидным в данных условиях. Верхний индекс «°» у теплового эффекта указывает на то, что все реагенты взяты в стандартном состоянии.
Стандартное состояние – это состояние чистого вещества при давлении
1 атм (101325 Па) и заданной температуре (Т =const). При этом вещества должны быть взяты в том агрегатном состоянии, в котором они являются термодинамически устойчивыми. В справочной литературе приводятся величины, характеризующие вещество в стандартном состоянии, определяемом более узко, а именно
р = 1 атм и Т = 298 К. Стандартную энтальпию реакции, протекающей при температуре Т, обозначают 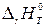 (индекс r означает «reaction» – реакция).
(индекс r означает «reaction» – реакция).
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать энтальпии тех химических процессов, для которых непосредственное определение Δr Н связано с большими экспериментальными затруднениями.
Пусть при p = const протекают реакции:
1) С + О2 → СО2 + Δr Н 1
2) СО + ½О2 → СО2 + Δr Н 2
3) С + ½О2 → СО + Δr Н 3
Энтальпии реакций (1) и (2) Δr Н 1 и Δr Н 2 могут быть определены с высокой точностью экспериментальным путем, в то время как энтальпию реакции (3) Δr Н 3 непосредственно измерить невозможно, так как при горении углерода наряду с СО всегда образуется СО2. На основании исходных данных удобно составить схему возможных путей образования СО2 (рис. 2).
 |
Рис. 2. Схема расчета по закону Гесса
В соответствии с законом Гесса энтальпия процесса, протекающего первым (прямым) путем, равна энтальпии процесса, протекающего вторым путем через промежуточное состояние:
Δr Н 1 = Δr Н 2 + Δr Н 3.
Неизвестная энтальпия Δr Н 3 равна
Δr Н 3 = Δr Н 1 – Δr Н 2.
Таким образом, определив опытным путем тепловые эффекты некоторых процессов, можно, используя закон Гесса, вычислить тепловые эффекты других процессов, связанных с первыми системой термохимических уравнений.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать тепловые эффекты (энтальпии) химических реакций.
1 следствие: тепловой эффект химической реакции, протекающей при температуре Т, равен разности сумм теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
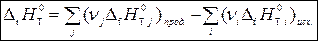 , (1)
, (1)
где  – стандартная энтальпия (теплота) образования вещества (индекс f означает «formation» – образование);
– стандартная энтальпия (теплота) образования вещества (индекс f означает «formation» – образование); 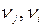 – стехиометрические коэффициенты продуктов реакции и исходных веществ.
– стехиометрические коэффициенты продуктов реакции и исходных веществ.
Стандартной энтальпией (теплотой) образования вещества при заданной температуре называют тепловой эффект реакции образования 1 моль данного вещества из соответствующих количеств простых веществ, находящихся в наиболее устойчивом стандартном состоянии. Согласно решению Международного союза чистой и прикладной химии (IUPAC) стандартные теплоты образования простых веществ принимаются равными 0 при любой температуре.
Стандартную энтальпию образования при Т = 298 К рекомендуется обозначать 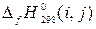 , где i – соединение; j – агрегатное состояние.
, где i – соединение; j – агрегатное состояние.
Например, стандартную теплоту образования воды при Т = 298 К обозначают  . Термохимическое уравнение реакции образования воды при Т = 298 К запишется
. Термохимическое уравнение реакции образования воды при Т = 298 К запишется
Н2 + ½О2 = Н2О (ж) + 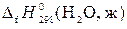 .
.
Стандартные энтальпии веществ при Т = 298 К приведены в справочниках.
В качестве примера рассмотрим расчет теплового эффекта химической реакции
СО2 + 4Н2 = СН4 + 2Н2О,
протекающей в газовой фазе при Т = 298 К и р = 1 атм.
Теплота образования водорода по определению равна 0. Следовательно, в соответствии с формулой (1), тепловой эффект данной реакции равен
 .
.
2 следствие: тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
 , (2)
, (2)
где  – стандартная энтальпия (теплота) сгорания вещества (индекс «с» означает «combustion» – сгорание).
– стандартная энтальпия (теплота) сгорания вещества (индекс «с» означает «combustion» – сгорание).
Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления 1 моль вещества до высших оксидов. Теплоты сгорания высших оксидов принимаются равными 0.
Например, термохимическое уравнение реакции сгорания глюкозы запишется:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О +  .
.
Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Стандартная теплота сгорания относится к проведению процесса при
p = 1 атм. В термодинамические таблицы сведены стандартные теплоты сгорания, рассчитанные для температуры 298 К.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 337; Нарушение авторских прав?; Мы поможем в написании вашей работы!