
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Центры ферментов
|
|
|
|
Строение ферментов
Ферменты являются глобулярными белками. Различают простые и сложные ферменты.
Простые ферменты представлены аминокислотными цепями и при гидролизе распадаются только на аминокислоты. К ним относятся гидролитические ферменты — пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др.
Большая часть природных ферментов является сложными белками и, помимо полипептидных цепей, содержит небелковый компонент (кофактор), являющийся абсолютно необходимым для белковой активности.
Кофакторы имеют различную химическую природу и различаются по прочности связи с полипептидной цепью.
Полипептидная часть фермента называется апоферментом,
Небелковая, легко диссоциирущая с белковой частью – коферментом,
прочно связанная с белком - простетической группой (кофактор), молекула в целом –холофермент.
Коферменты и кофакторы активно участвуют и химических реакциях, играя роль переносчиков протонов, электронов или различных функциональных групп. Эти группы определяют специфичность действия ферментов, участвуют в связывании фермента с субстратом, стабилизируют белковую часть фермента.
Коферменты и кофакторы связаны с апоферментом водородными, ионными гидрофобными связями.
Кофактором называется любой фактор, абсолютно необходимый для выполнения белком его биологической роли. Им могут быть любые небелковые органические молекулы или ионы металлов.
Коферменты представлены водорастворимыми витаминами (группы В, витамин Н, РР), нуклеотидные производные, липоевая кислота, фосфорные эфиры некоторых полисахаридов.
Молекулы субстратов, участвующих в химических реакциях, значительно меньше молекул ферментов. При образовании комплекса «субстрат — фермент» во взаимодействие с субстратом вовлекается ограниченная часть молекулы фермента.
Активный центр фермента — уникальная комбинация аминокислотных остатков в молекуле фермента, которая обеспечивает непосредственное ее связывание с субстратом и участвует в акте катализа. У сложных ферментов в состав активного центра входят простетические группы, коферменты.
В активном центре различают каталитический центр – участок фермента, непосредственно вступающий в химическое взаимодействие с субстратом.
Субстратный центр или контактная площадка – участок фермента, обеспечивающий специфическое связывание субстрата и образование комплекса – «фермент – субстрат».
Аллостерический центр – участок фермента, в котором может происходить связывание фермента с низкомолекулярными веществами. В результате изменяется третичная структура фермента и изменяется его сродство к субстрату т е. изменяется каталитическая активность фермента.
За единицу активности фермента принимают такое его количество, которое катализирует превращение 1 микромоля вещества в 1 мин при 25 оС.
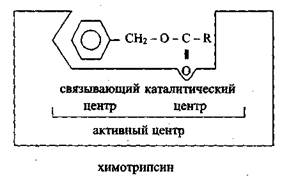
Формирование активного центра фермента начинается на ранних этапах его синтеза, когда линейная полипептидная цепь превращается в трехмерное тело с определенной конфигурацией. Белок со сформированной третичной структурой приобретает функциональную (в частности, каталитическую) информацию. Любые воздействия, приводящие к денатурации фермента (нарушению его третичной структуры), нарушают структуру активного центра и ведут к потере ферментом каталитических свойств. При восстановлении нативной трехмерной структуры белка-фермента (ренатурации) восстанавливается и его каталитическая активность.
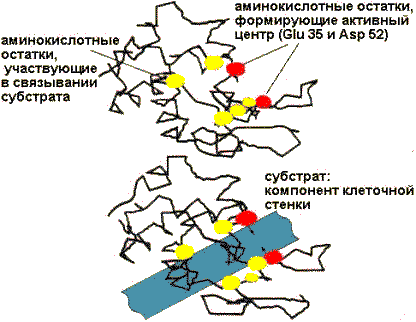 Важнейшие аминокислотные остатки в активном центре лизоцима
Важнейшие аминокислотные остатки в активном центре лизоцима
|
У некоторых ферментов в активном центре располагается и кофактор. Одни R-группы активного центра принимают участие в связывании субстрата, другие - в катализе.
Мультимолекулярные (надмолекулярные) ферментные системы — комплексы, состоящие из различных по строению ферментов, катализирующих последовательные ступени превращения определенного субстрата. Их особенностями является прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадий во времени, определяемая порядком расположения ферментов в пространстве.
Молекулярная масса таких комплексов колеблется от 2,3 X 106 до10 X 10б. Образование подобных систем резко сокращает расстояния, на которые перемещаются молекулы субстратов. Мультимолекулярные ферментные системы могут быть структурно связанными с какой-либо органеллой (рибосомой, митохондрией) или с биомембраной, такие системы обеспечивают жизненно важные для клетки функции (например, тканевое дыхание, окисление жирных кислот, ЦТК). К мультиферментным системам относятся пируватдегидрогеназный и а-етоглутаратдегидрогеназный комплексы..
Классификация и номенклатура ферментов.
В основу принятой классификации ферментов положен принцип типа катализируемой реакции. Согласно Международной классификации ферменты делят на шесть главных классов.
1.Оксидоредуктазы — ферменты, катализирующие окислительно-восстановительные реакции. Систематические названия составляются по схеме: «донор: акцептор оксидоредуктаза» (например, лактат: НАД+ оксидоредуктаза). Среди оксидоредуктаз различают аэробные дегидрогеназы, или оксидазы (катализируют перенос протонов или электронов на кислород), анаэробные дегидрогеназы (катализируют перенос протонов или электронов на промежуточный субстрат), цитохромы (катализируют перенос только электронов). К оксидоредуктазам относятся гемсодержащие ферменты: каталаза и пероксидаза.
2.Трансферазы — ферменты, катализирующие реакции межмолекулярного переноса атомов, групп атомов и радикалов. Систематические названия составляются по схеме: «донор: транспортируемая группа — трансфераза». Среди трансфераз выделяют катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков кислот.
3.Гидролазы — ферменты, катализирующие расщепление внутримолекулярных связей при участии молекул воды. Систематические названия составляются по схеме: «субстрат — гидролаза». К гидролазам относятся
- эстеразы (катализируют реакции гидролиза и синтеза сложных эфиров),
- гликозидазы (катализируют разрыв гликозидных связей),
- фосфатазы,
- пептидазы и амидазы (катализируют разрыв фосфоангидридных, пептидных и амидных связей).
4.Лиазы — ферменты, катализирующие разрыв связей С—О, С—С, С—-N, реакции негидролитического отщепления различных групп от субстратов. Реакции сопровождаются образованием двойной связи или присоединением к месту разрыва двойной связи. Систематические названия составляются по схеме: «субстрат — лиаза».
5.Изомеразы — ферменты, катализирующие геометрическую и оптическую изомеризацию. Систематические названия составляются по схеме: «субстрат-цис-транс-изомераза». При внутримолекулярном переносе группы фермент называется «мутаза».
6.Лигазы (синтетазы) — ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии макроэрга (АТФ или др.). Систематические названия составляются по схеме: «X: Y лигаза», где X и Y — исходные вещества.
Список ферментов содержит для каждого фермента кодовый номер (шифр), систематическое (рациональное) название, рекомендуемое (рабочее) название, химическую реакцию, катализируемую им, и примечания о специфичности действия.
Код каждого фермента состоит из четырех цифр, разделенных точками: номер главного класса фермента, номер подкласса, номер подгруппы в подклассе и порядковый номер фермента
В живой клетке множество разнообразных соединений, но реакции между ними образуют строго определенные метаболические пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который генетически запрограммирован. Отсутствие даже одного фермента или какой-нибудь его дефект может привести к серьезным отклонениям в организме.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 4420; Нарушение авторских прав?; Мы поможем в написании вашей работы!