
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические основы перманганатометрии
|
|
|
|
Методы оксидиметрии и их классификация
И комплексонометрического титрования
ПЛАН:
8.1 Методы оксидиметрии и их классификация
8.1.1 Теоретические основы перманганатометрии
8.1.2 Метод иодометрии
8.2 Комплексонометрическое титрование, его виды
8.2.1 Комплексоны и их особенности
8.2.2 Индикаторы комплексонометрии
8.3 Применение методов оксидиметрии и комплексонометрии в медицине
Окислительно-восстановительное титрование (редокс-метрия) основано на реакциях окисления-восстановления. При его проведении титруемое вещество вступает в ОВР с титрантом. Если титрант – окислитель, то титрование называют окислительным, при титранте-восстановителе – восстановительным.
Окислительно-восстановительных реакций известно много. Для количественного анализа подходят только те немногие, которые отвечают определенным критериям (см. лекцию 7).
Титрантами в методах редокс-метрии служат растворы окислителей и восстановителей. В зависимости от условий они могут вступать в реакции, в которых участвует различное количество электронов. Поэтому часто титранты не имеют постоянного эквивалента.
Например, в кислой среде MnO4‾ присоединяет 5 ē и восстанавливается до Mn2+;
в щелочной среде – 1 ē и восстанавливается до MnO42‾;
в нейтральной – 3 ē и восстанавливается до MnO2.
Поэтому в кислой среде Мэкв.(KMnO4) = 158 / 5 = 31,6 г/моль;
в щелочной Мэкв.(KMnO4) = 158 г/моль;
в нейтральной – Мэкв.(KMnO4) = 158 / 3 = 52,67 г/моль.
В методах редокс-метрии чаще употребляют в качестве титрантов окислители в связи с большей устойчивостью их растворов (раствор K2Cr2O7 устойчив до 24 лет). Растворы восстановителей менее устойчивы (окисление О2 воздуха), хранятся непродолжительное время.
В настоящее время разработано свыше 50 методов окислительно-восстановительного титрования. Их называют по типу применяемого титранта (перманганатометрическое, йодометрическое, броматометрическое, дихроматометрическое и т.д.).
Используется несколько видов ОВ титрования: прямое, обратное, заместительное.
Прямое титрование проводят при ЭДС ≥ 0,4 В, что обеспечивает необходимую полноту и скорость протекания реакции. Прямым титрованием определяют йод (титрант – раствор Na2S2O3, ЭДС = 0,42 В, Кр = 1012), Fe(II) (титрант – раствор KMnO4, ЭДС = 0,74 В, Кр = 106,4).
Обратное титрование используется при медленно протекающих окислительно-восстановительных реакциях. При этом к титруемой смеси добавляют избыток титранта I и выдерживают определенное время. Затем избыток титранта I оттитровывают другим титрантом II. Такой способ применяют при определении сульфидов (к раствору Na2S добавляют р-р I2 – титрант I, остаток которого титруют раствором Na2S2O3 – титрантом II):
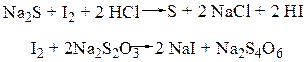
Заместительное титрование проводят, определяя заместитель – выделяющийся в эквивалентном количестве продукт реакции определяемого вещества с каким-либо реактивом. Таким видом анализируются вещества, не вступающие в ОВР. Например, CaCO3 можно проанализировать, растворяя его в HCl и после нейтрализации раствора, осаждая раствором (NH4)2C2O4 в виде осадка CaC2O4. Осадок затем обрабатывают H2SO4 и выделившуюся щавелевую кислоту (заместитель) титруют раствором KMnO4:

Т.О., окислительно-восстановительное титрование основано на использовании окислительно-восстановительных реакций:
Ох1 + Rеd2 ↔ Rеd1 + Ох2
Метод перманганатометрии основан на реакциях окисления различных веществ калия перманганатом (KMnO4). Процесс осуществляют в сильно кислой среде, т.к. MnO4‾ проявляет в этом случае наиболее сильные окислительные свойства:


Продукт восстановления MnO4‾ – Mn2+ – бесцветный ион. Метод безиндикаторный, т.к. розовая окраска, обусловленная MnO4‾, хорошо заметна от одной избыточной капли.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 853; Нарушение авторских прав?; Мы поможем в написании вашей работы!