
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Силы и потенциальная энергия межмолекулярного взаимодействия
|
|
|
|
ЛЕКЦИЯ № 17.
Реальные газы, жидкости и твёрдые тела.
Силы и потенциальная энергия межмолекулярного взаимодействия. Реальные газы и жидкости. Уравнение Ван – дер –Ваальса. Фазовые переходы. Уравнение Клапейрона – Клаузиуса. Поверхностное натяжение. Смачивание.
При моделировании газовых процессов мы широко использовали модель идеального газа, полагая молекулы такого газа материальными точками, имеющими массу, но не обладающие размерами. Взаимодействие таких молекул описывалось как столкновительные процессы, подчиняющиеся классической механике Ньютона. Такая модель позволяет удовлетворительно описывать поведение достаточно разреженных реальных газов при достаточно высоких температурах и достаточно низких давлениях.
Однако, молекулы любого реального газа имеют вполне конкретные размеры (в среднем радиус молекулы равен примерно 10-10 м), поэтому при высоких давлениях (~ 500 МПа) объём молекул будет составлять около половины всего объёма, занимаемого газом. При низких температурах модель идеального газа даёт значение объёма газа, стремящегося к нулю. Следовательно, при высоких давлениях и низких температурах модель идеального газа непригодна.
Понятно, что при рассмотрении реальных газов необходимо будет учитывать реальное взаимодействие молекул друг с другом – учитывать силы межмолекулярного взаимодействия, а не только процессы столкновения молекул друг с другом. Как показывает опыт, силы межмолекулярного взаимодействия проявляются на расстояниях менее 10-9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими.
Обычно суммы положительных и отрицательных зарядов в молекуле равны друг другу и молекула в целом электронейтральна. Благодаря этому электрическое поле за пределами молекулы очень быстро убывает с расстоянием и практически обращается в нуль уже на расстоянии двух – трёх диаметров её электронной оболочки.
При сближении молекул, на расстояниях порядка двух их диаметров, между молекулами начинает постепенно проявляться взаимодействие электрических зарядов ядер и электронных оболочек молекул – они взаимно поляризуют друг друга так, что в результате между молекулами возникнут силы притяжения Fприт.
По мере дальнейшего сближения молекул их деформация и величина сил притяжения Fприт. будут возрастать. Однако, когда молекулы подойдут " вплотную " друг к другу и " соприкоснутся " своими электронными оболочками, то между электронными оболочками возникнут силы отталкивания, резко возрастающие по мере дальнейшего взаимного проникновения оболочек. На таких расстояниях молекулы будут отталкиваться.
Общий характер сил взаимодействия между молекулами любого строения Fвз. от расстояния r между центрами молекул будет качественно одинаков – притяжение на больших расстояниях и отталкивание на малых.
Рис. 17 а. Зависимость сил межмолекулярного взаимодействия от расстояния между центрами взаимодействующих молекул r. (Рис. 3.2 из ЗиТ, стр.198).
На рис. 17 а изображена примерная зависимость сил межмолекулярного взаимодействия Fвз. от расстояния между центрами молекул r. З начения Fвз.<0 соответствуют силам притяжения, а значения Fвз. > 0 – силам отталкивания. Естественно, что на некотором, характерном для данной конкретной пары взаимодействующих молекул, расстоянии r0 (не путать с радиусами молекул!) притяжение и отталкивание уравновешивают друг друга и результирующая сила взаимодействия молекул обращается в нуль:
Fвз.(r0) = 0. Это расстояние r0 соответствует положению равновесия, в котором могут находиться молекулы газа в отсутствие теплового движения.
При небольшом изменении взаимного расстояния между центрами молекул от величины r до величины r + dr силы взаимодействия будут совершать работу:
D А = Fвз. Dr. (17.1)
Следовательно, потенциальная энергия взаимодействия молекул будет меняться на величину DU:
DU = - D А = - Fвз. Dr. (17.2)
Выберем начало отсчёта для значений энергии взаимодействия молекул при r = ∞, когда потенциальная энергия взаимодействия равна нулю:
U (∞)= 0. (17.3)
Рис. 17.2. Потенциальная энергия межмолекулярного взаимодействия в зависимости от расстояния между центрами взаимодействующих молекул r
(Рис. 3.2. из ЗиТ, стр. 198).
При постепенном уменьшении r (Δ r < 0) между молекулами появляются силы притяжения (Fвз. < 0), которые при сближении молекул совершают положительную работу (ΔА = Fвз. Δr > 0) и потенциальная энергия взаимодействия молекул согласно уравнения (17.2) постепенно уменьшается и в соответствии с (17.3) будет отрицательной, причём, при некотором значении r = r0 достигнет своего наименьшего значения U (r0) = Umin ., (см. рис. 17.2), когда Fвз. = 0 (см. рис. 17.1.).
При переходе через положение равновесия при r = r0 и дальнейшем сближении молекул, между ними возникнут силы отталкивания (Fвз. > 0) и совершаемая против этих сил работа будет отрицательной (ΔА = Fвз. *Δr<0) и потенциальная энергия взаимодействия начнёт круто возрастать.
Как видно из рис. 17.2, кривая потенциальной энергии U = U (r) имеет характерный вид так называемой " потенциальной ямы ", которая имеет наибольшую глубину в положении равновесия при r = r0, когда:
Fвз.= 0; U = Umin. < 0 (17.4)
- это соответствует устойчивому положению взаимодействующих молекул.
Глубина ямы  определяет величину работы, которую нужно совершить против сил притяжения, для того, чтобы молекулы, оказавшиеся в равновесии (при r = r0), оторвать друг от друга и развести их на бесконечное расстояние:
определяет величину работы, которую нужно совершить против сил притяжения, для того, чтобы молекулы, оказавшиеся в равновесии (при r = r0), оторвать друг от друга и развести их на бесконечное расстояние:
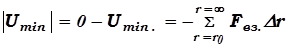 . (17.5)
. (17.5)
Поскольку средняя кинетическая энергия хаотического теплового движения молекул имеет порядок kT, то структура любой совокупности молекул и агрегатное состояние вещества будут существенно зависеть от соотношения величин | Umin. | и kT.
А). При низких температурах, когда kT << | Umin. |, молекулы притягиваются друг к другу и располагаются практически вплотную друг к другу в определённом порядке – вещество будет находиться в твёрдом агрегатном состоянии.
Б). В противоположном предельном случае высоких температур, когда kT>>| Umin. |, интенсивное тепловое движение молекул будет препятствовать их соединению в агрегаты из нескольких частиц, сблизившихся до расстояния r0 – вещество в этом случае будет находиться в газообразном агрегатном состоянии.
В). При промежуточных температурах газа, когда kT ≈ | Umin. |, благодаря тепловому движению молекулы будут непрерывно перемещаться в пространстве, обмениваясь местами, но, не увеличивая взаимных расстояний на величину, заметно превышающую величину r0. Вещество при этом будет находиться в жидком агрегатном состоянии.
Температура перехода вещества из одного агрегатного состояния в другое зависит от конкретного значения | Umin. | для данного вещества (для металлов | Umin. | велико и они плавятся и испаряются при высоких температурах).
Агрегатное состояние вещества зависит не только от его температуры, но и от объёма V, занимаемого системой его молекул. При достаточно большом значении V молекулы вещества имеют возможность расходиться друг от друга на расстояния, на которых средняя энергия сил притяжения оказывается достаточно малой по сравнению с величиной kT. Поэтому над твёрдым телом или жидкостью всегда присутствует небольшое количество того же вещества в газообразном состоянии.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1252; Нарушение авторских прав?; Мы поможем в написании вашей работы!