
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальный газ. Уравнение Ван – дер – Ваальса
|
|
|
|
Как мы уже упоминали, при низких температурах и высоких давлениях уравнение состояния идеального газа Менделеева – Клапейрона непригодно.
Учитывая собственный объём молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван – дер – Ваальс (1837 – 1923 г.г.) вывел уравнение " реального газа ", используя две поправки для уравнения Менделеева – Клапейрона.
Учёт собственного объёма молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объём других молекул, приводит к тому, что фактический свободный объём, в котором могут двигаться молекулы реального газа, будет равен не Vμ (как в уравнении Менделеева – Клапейрона для одного моля газа), а V = (Vμ-b), где b – поправка на собственный объём молекул.
Можно показать, что поправка b равна учетверённому объёму молекул. Действительно, если, например, сближаются две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы (оболочки молекул считаются непроницаемыми). Это означает, что для центров обеих молекул оказывается недоступным сферический объём радиуса d, т.е. объём, равный восьми объёмам молекулы или учетверённому объёму молекулы в расчёте на одну молекулу.
Учёт притяжения молекул. Поскольку при определённых расстояниях между молекулами действуют силы притяжения (а они, как мы уже говорили, проявляются раньше сил отталкивания), то их действие приводит к появлению " дополнительного " действия на молекулы " идеального " газа. Это давление Ван – дер – Ваальс назвал " внутренним " давлением. По модели "реального" газа вычисления показали, что " внутреннее " давление молекул обратно пропорционально квадрату молярного объёма, т.е.:
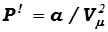 , (17.6)
, (17.6)
где а – вторая постоянная (поправка) Ван – дер – Ваальса, характеризующая действие сил межмолекулярного притяжения, Vμ – молярный объём газа.
Вводя эти поправки, получим итоговое уравнение Ван – дер – Ваальса для одного моля газа:
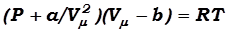 . (17.7)
. (17.7)
Для произвольного количества вещества в ν молей газа (т.к. ν = m/Mμ) с учётом того, что V = ν Vμ, уравнение Ван – дер – Ваальса примет вид:
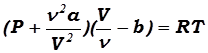 , (17.8)
, (17.8)
где поправки a и b – постоянные для каждого индивидуального газа величины, вычисляемые из экспериментальных данных (в простейшем случае записываются уравнения Ван – дер – Ваальса для двух известных из опыта состояний газа и решаются относительно величин a и b).
Поскольку при выводе уравнения для " реального " газа Ван – дер – Ваальсом был сделан ряд весьма существенных упрощений, поэтому оно так же, как и уравнение Менделеева – Клапейрона является достаточно приближённым уравнением, которое, однако, лучше (особенно для не очень сильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Для более точного описания опытных данных для реальных газов пользуются эмпирическими уравнениями состояния, чаще всего уравнением Камерлинг – Оннеса, имеющим вид:
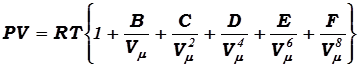 , (17.9)
, (17.9)
которое построено с таким расчётом, чтобы всегда имелась возможность привести это уравнение к согласию с данными опыта простым вписыванием дополнительных членов без изменения формы уравнения. Коэффициенты B,C, F называются вириальными коэффициентами и представляются в виде многочленов, расположенных по возрастающим степеням Т-1 :
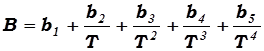 , (17.10)
, (17.10)
и аналогично для коэффициентов C,D,E,F.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 933; Нарушение авторских прав?; Мы поможем в написании вашей работы!