
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные жидкости
|
|
|
|
Изотермы Ван – дер – Ваальса и их анализ.
Для исследования поведения реального газа, описываемого уравнением Ван – дер – Ваальса, рассмотрим зависимости P (Vμ) для заданных температур – так называемые изотермы Ван – дер – Ваальса (с м. рис. 17.3) для одного моля газа.
Рис. 17.3. Изотермы Ван – дер – Ваальса для различных температур. (Рис. 89, Трофимова, стр. 122)
Кривые, построенные для четырёх различных температур (рис. 17.3), имеют своеобразный характер. При достаточно высоких температурах (Т4 > Тк) изотерма " реального газа " по Ван – дер – Ваальсу отличается от изотермы идеального газа (уравнение Менделеева - Клапейрона) только некоторым искажением формы кривой, оставаясь монотонно спадающей функцией объёма.
При некоторой температуре Тк = Т3 на изотерме появляется единственная точка перегиба К. Такая изотерма называется критической, а соответствующая ей температура Т3 = Тк называется критической температурой. Точка перегиба К называется критической точкой - в этой точке объём Vк и давление Рк называются также критическими.
Состояние газа с критическими параметрами (Pk ,Vk ,Tk) называется критическим состоянием.
Для пояснения характера поведения изотерм, преобразуем уравнение Ван – дер – Ваальса (17.7) для одного моля газа к виду:
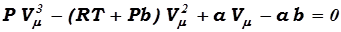 . (17.11)
. (17.11)
При заданных Р и Т, уравнение (17.11) является уравнением третьей степени относительно Vμ, следовательно, оно может иметь либо три вещественных корня, либо один вещественный корень и два мнимых, причём, физический смысл будут иметь лишь вещественные положительные корни. Поэтому первому случаю (три вещественных корня) будут соответствовать изотермы при низких температурах (три значения объёма газа V1, V2 , V3 отвечают одному значению давления Р1), а второму случаю будут соответствовать изотермы при высоких температурах.
Рассмотрим подробнее различные участки изотермы при T < Tk (три вещественных корня). Из рисунка 17.4 видно, что на участках 1 – 3 и 5 – 7 при уменьшении объёма Vμ давление Р возрастает, что соответствует физической реальности. На участке 3 – 5 (показано пунктиром) график показывает, что сжатие вещества (газа) приводит к уменьшению давления, хотя эксперимент показывает, что такие состояния в природе не осуществляются.
Рис. 17.4. Поведение изотерм Ван – дер – Ваальса при температурах, меньшей критической. (Рис. 90, Трофимова, стр. 123).
Наличие участка 3 – 5 означает, что при постепенном изменении объёма вещество (газ) не может оставаться всё время в виде однородной среды. В некоторый момент должно наступить скачкообразное изменение его состояния и распад вещества на две фазы.
Таким образом, истинная изотерма реального газа, соответствующая физическому смыслу, должна иметь вид ломаной линии 7 – 6 – 2 - 1. При этом её часть 6 – 7 будет отвечать газообразному состоянию вещества, а часть 2 – 1 – жидкому состоянию (Т < Ткр.!).
В состояниях, соответствующих горизонтальному участку изотермы 6 – 2 наблюдается равновесие жидкой и газообразной фаз вещества.
Вещество в газообразном состоянии при температуре ниже критической, называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Данные выводы, следующие из анализа уравнения Ван – дер – Ваальса, были подтверждены опытами ирландского учёного Т. Эндрюса (1813 – 1885 г.г.), изучавшего изотермическое сжатие углекислого газа при различных температурах. Отличие экспериментальных данных (Эндрюса) и теоретических (Ван – дер - Ваальса) в поведении изотерм заключается в том, что превращению газа в жидкость на экспериментальных кривых соответствуют горизонтальные участки, а на теоретических – волнообразные.
Если проанализировать уравнение Ван – дер – Ваальса при Т = Тк, когда существует только один вещественный корень, а точнее – все три корня совпадают и равны Vк), то уравнение (17.11) может быть приведено к виду:
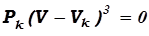 . (17.12)
. (17.12)
Из уравнений (17.11) и (17.12) можно получить:
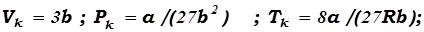 , (17.13)
, (17.13)
т.е. критические параметры реального газа могут быть выражены через поправки Ван – дер – Ваальса, и наоборот.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 396; Нарушение авторских прав?; Мы поможем в написании вашей работы!