
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Серная кислота, ее производство
|
|
|
|
Серный ангидрид
Прочие формы вредного воздействия диоксида серы.
В то время как железо в нейтральной и даже во влажной атмосфере лишь в небольшой мере подвержено коррозии, кислотность присутствующей в атмосфере влаги, поглотившей из воздуха SO2, вызывает усиление коррозии и тем самым чрезвычайно большой материальный ущерб. Такие чувствительные к кислотам материалы, как известняк и бетон, подвергаются быстрому разрушению в атмосфере, содержащей SO2.
| Наименование вещества | № CAS | Предельно-допустимая концентрация максимально разовая (мг/м3) | Класс опасности | ||
| Максимально разовая, ПДКмр | Среднесуточная, ПДКсс | ||||
| Сера диоксид | 7446-09-5 | 0,5 | 0,05 |
Отравление диоксидом серы:
Сернистый ангидрид раздражает преимущественно верхние, а при более сильном воздействии также и глубокие дыхательные пути. Очень высокие концентрации выбросов диоксида серы приводят к острому бронхиту, одышке и быстро наступающим расстройством сознания.
- Предельно допустимая максимальная разовая концентрация сернистого газа в атмосферном воздухе составляет 0,5 мг/м³.
- В воздухе рабочей зоны 10 мг/м³.
У рабочих, постоянно вдыхающих выбросы SO2, наблюдается до известной степени привыкание, и они переносят без видимых признаков раздражения слизистых оболочек концентрацию 0.1 — 0.12 мг/л и даже сравнительно легко выдерживают концентрацию 0.2 мг/л.
Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3. Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест.
.
Динамика производства серной кислоты в мире приведена на рис.
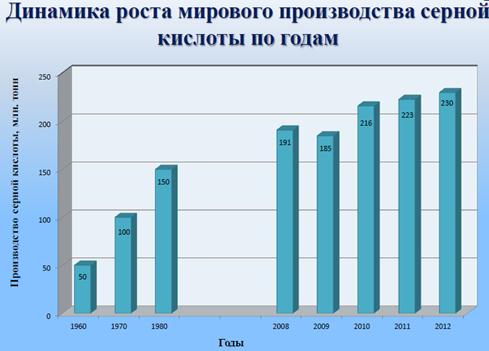
рис. Динамика производства серной кислоты в мире
Из рисунка видно, что объем производства за последние 50 лет увеличился в 4,5 раза.
Соотношение объемов серной кислоты, произведенной различными способами получения приведено на рис.

Рис. Соотношение объемов серной кислоты, произведенной различными способами получения

Рис. Мировые лидеры по производству серной кислоты

Рис. Структура производства серной кислоты в РФ из различного сырья (За последние годы самый неэкологичный способ производства серной кислоты из пирита практически закрыт в 2008 г.)
Основными производителями серной кислоты являются предприятия фосфорных удобрений. Производство серной кислоты основано на использовании самородной серы (Водинское месторождение в Самарской области), серного колчедана (месторождения медно-колчеданных руд на Урале), а также отходящих промышленных сернистых газов чернометаллургических (Нижний Тагил, Пермь, Первомайск, Челябинск) и медеплавильных производств (Красноуральск, Ревда, Карабаш, Медногорск) в Уральском районе. Кроме того, в качестве сырья применяется сера, получаемая при очистке серосодержащего природного газа на газоперерабатывающих комплексах (в Оренбурге на Урале, Астрахани в Поволжском районе) и при переработке сернистой нефти на нефтеперерабатывающих заводах (Поволжье и Урал).

Главные районы размещения сернокислотных производство — Уральский, Поволжский, Восточно-Сибирский, Западно-Сибирский, Северо-Кавказский. Производство серной кислоты из-за трудностей, связанных с опасностью ее транспортировки, тяготеет преимущественно к местам ее потребления — к заводам фосфорных удобрений и другим химическим производствам, к сырьевым источникам — предприятиям черной и цветной металлургии, газо- и нефтепереработки в порядке комбинирования и кооперирования с этими производствами
Серная кислота – важнейший продукт химической промышленности. Она находит применение в производстве минеральных удобрений, волокон, пластмасс, красителей, взрывчатых веществ, в металлургии при получении меди, никеля, урана и других металлов. Используется и как осушитель газов. Много серной кислоты идет на очистку нефтепродуктов от вредных примесей. Большое практическое применение из солей серной кислоты имеют различные сульфаты.
1.Медный и железный купоросы (купоросами называют кристаллогидраты сульфатов некоторых металлов (меди, железа, цинка и никеля):
CuSO4 ∙ 5H2O, и FeSO4 ∙ 7H2O
используются в сельском хозяйстве для борьбы с вредителями растений, в производстве красок, для пропитки древесины в качестве антисептического средства.
2. Гипс CaSO4 ∙ 2H2O и сульфат кальция CaSO4 используют в строительстве, медицине и других областях. Из гипса при прокаливании получают алебастр CaSO4 ∙ 0,5H2O:
CaSO4 ∙ 2H2O = CaSO4 ∙ 0,5H2O + 1,5H2O
Алебастр, смешанный с водой, быстро затвердевает, превращаясь в гипс:
CaSO4 ∙ 0,5H2O + 1,5Н2О = CaSO4 ∙ 2H2O
3. Сульфат натрия Na2SO4 используется в производстве стекла.
4. Сульфаты калия K2SO4 и аммония (NH4)2SO4 применяют как удобрения. 5. Сульфат бария BaSO4 применяется в производстве бумаги, резины и минеральных красок.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 894; Нарушение авторских прав?; Мы поможем в написании вашей работы!