
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика серной кислоты
|
|
|
|
Безводная серная кислота – тяжелая бесцветная маслянистая жидкость, растворяющаяся в воде в любых соотношениях. Она гигроскопичная, нелетучая, без запаха, не проводит электрический ток. При температуре 10,3 °C затвердевает, образуя кристаллы, похожие на лёд. Температура кипения составляет 296,2 °С, при дальнейшем повышении температуры она разлагается. Плотность 1,83 г/мл (200 °С). Это молекулярное вещество, относящееся к сильным двухосновным кислотам. Растворы SO3 в серной кислоте называют олеумом, они образуют два соединения H2SO4•SO3 и H2SO4•2SO3. Олеум содержит также пиросерную кислоту, получающуюся по реакции: Н2SO4 + SO3=H2S2O7.
Химические свойства серной кислоты во многом зависят от её
концентрации. В лабораториях и промышленности применяют разбавленную и концентрированную серную кислоту, хотя это деление условно (четкую границу между ними провести нельзя).
Взаимодействие с металлами.
Разбавленная серная кислота взаимодействует с некоторыми металлами, например с железом, цинком, магнием, с выделением водорода:
Fe + H2SО4 = FeSO4 + H2↑
Некоторые малоактивные металлы, такие как медь, серебро, золото, с разбавленной серной кислотой не реагируют.
Концентрированная серная кислота является сильным окислителем. Она окисляет многие металлы. Продуктами восстановления кислоты
обычно является оксид серы (IV), сероводород и сера (H2S и S образуется в реакциях кислоты с активными металлами - магнием, кальцием, натрием, калием и др.).
Примеры реакций:
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O
Mg + 2H2SO4 = MgSO4 + SO2+ 2H2O или
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивации связано с образованием на поверхности металла прочной сплошной пленки, состоящей из оксидов или других любых соединений, которая препятствует контакту металла с кислотой. Благодаря пассивации можно перевозить и хранить концентрированную серную кислоту в стальной таре. Концентрированная серная кислота пассивирует также алюминий, никель, хром, титан.
Взаимодействие с неметаллами.
Концентрированная серная кислота может окислять неметаллы, например:
S + 2H2SO4 = 3SO2 + 2H2O
Окислительные свойства концентрированной серной кислоты могут также проявляться с некоторыми сложными веществами – восстановителями, например:
2KBr + 2H2SO4 = Br2 + SO2 + K2SO4 + 2H2O
Взаимодействие с основными оксидами и основаниями.
Серная кислота проявляет все типичные свойства кислот. Так, она реагирует с основными и амфотерными оксидами и гидроксидами с образованием солей. Как двухосновная кислота H2SO4 образует два типа солей: средние соли – сульфаты и кислые соли – гидросульфаты.
Примеры реакций:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
сульфат алюминия
2KOH + H2SO4 = K2SO4 + 2H2O
сульфат калия
KOH + H2SO4 = KHSO4 + H2O
гидросульфат калия
Гидросульфаты образуются, когда кислота берётся в избытке. Многие соли серной кислоты выделяются из растворов виде кристаллогидратов, например:Al2 (SO4)3 ∙18H2O;Na2SO4 ∙ 10H2O
Взаимодействие с солями.
С некоторыми солями кислота вступает в реакции обмена, например:
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
BaCl2+ H2SO4 = ВаSO4 + 2HCl
Последняя реакция является качественной на серную кислоту и ее соли: об их присутствии в растворе судят по образованию белого осадка BaSO4, который практически не растворяется в концентрированной азотной кислоте.
Взаимодействие с водой.
При растворении в воде серная кислота активно взаимодействует с ней образуя гидраты:
nH2O + H2SO4 = H2SO4 ∙ nH2O
где n = 1, 2, 3, 4 и 6,5.
Благодаря способности связывать воду серная кислота является хорошим осушителем.
Схема применения серной кислоты
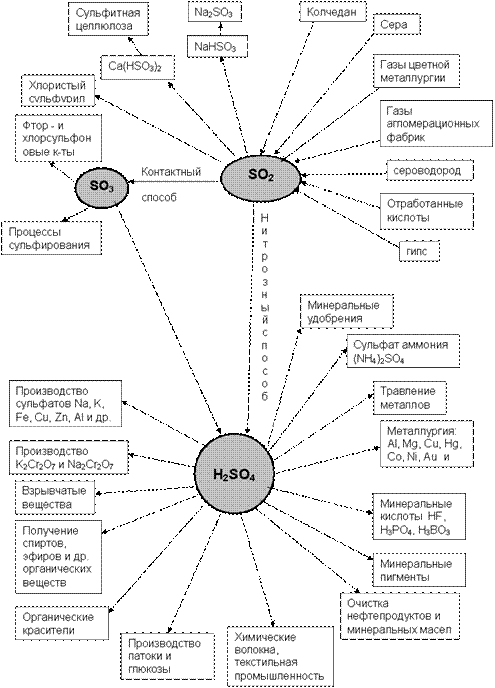
Рис. Основные направления использования серной кислоты
Основные способы получения серной кислоты – контактный, с использованием твердых катализаторов (контактов), и нитрозный - с оксидами азота.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 5902; Нарушение авторских прав?; Мы поможем в написании вашей работы!