
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Производство серной кислоты контактным способом
|
|
|
|
Исходным сырьём для производства серной кислоты могут быть: сера, сероводород, сульфиды металлов.
Принципиальная схема производства серной кислоты из серы представлена на рисунке:

Рис. Принципиальная схема производства серной кислоты из серы
1 – осушка воздуха, 2 – сжигание серы, 3 – охлаждение газа,
4 – контактирование, 5 – абсорбция оксида серы SO3.
При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция: S + O2 = SO2 с выделением очень большого количества теплоты: изменение Н= -362,4кДж/моль, или в пересчете на единицу массы 362,4/32=11,325 кДж/т = 11325кДж/кг S. Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6 0С; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция).Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжиганиярасплавленной серы используют два типа печей – форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата. Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты. Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Если воздух берут в стехиометрическом количестве, т.е. на каждый моль серы 1 моль кислорода, то при полном сгорании серы концентрация будет равна объемной доле кислорода в воздухе Сso2.max =21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура. При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит ~ 15000С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 13000С быстро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14% SO2.
Рассмотрим производство серной кислоты контактным способом, при котором исходным сырьём является пирит - FeS2.
Весь процесс можно разбить на три последовательных стадии:
· получение диоксида серы,
· окисление его до триоксида,
· поглощение триоксида серы.
Конструкция аппаратуры.
Для обжига колчедана применяются специальные печи. Наиболее эффективны печи со взвешенным («кипящим») слоем колчедана. В печах такой конструкции частицы колчедана находятся во взвешенном состоянии благодаря потоку воздуха, который подается противотоком (снизу через решетку в печи), а колчедан поступает через загрузочное отверстие в верхней части печи. Эффективность работы таких печей (1800 кг/м3 в сутки) намного выше, чем соответствующих аппаратов другой конструкции.
Обжиг пирита, получение диоксида серы. Очистка печного газа.
4FeS2 + 11O2 =2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в " кипящем слое ". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 8000С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета. За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений. Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве). Таким образом выполняется принцип химического производства - безотходность производства.
В результате обжига пирита получается обжиговый газ, состав которого: диоксид серы, кислород, азот, пары воды и другие примеси. Некоторые из этих примесей вредны для последующих процессов производства кислоты, поэтому обжиговый газ подвергают тщательной очистке от твердых частиц и влаги.
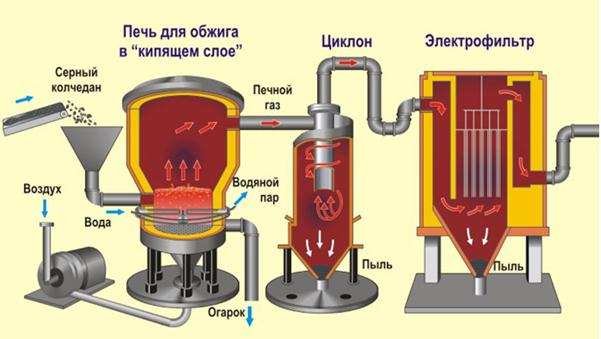
Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз). Для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы - SO2 и кислорода - О2.
Окисление SO2 в SO3 кислородом (получение триоксида серы)
2SO2 + O2 =2SO3 + Q
Реакция протекает в контактном аппарате. Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
а)температура:
Прямая реакция является экзотермической (+Q), согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём установлено, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500 °С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре, в реакцию вводят катализатор. Установлено, что наилучшим катализатором для этого процесса является оксид ванадия (V) - V2O5.
б)давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2VSO2 и 1VO2), а справа - 2V SO3. Раз прямая реакция протекает с
уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать.
Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500 °С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления оксида серы (IV) - SO2 в оксид серы (VI) - SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
4. Поглощение триоксида серы. Получение H2SO4
Протекает в поглотительной башне, в которую поступает полученный оксид серы (VI). Оксид серы SO3 не поглощают водой. Можно было бы оксид серы растворить в воде, с получением серной кислоты:
SO3 + H2O =H2SO4
Но, если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4 · nSO3.
Уравнение реакции этого процесса:
nSO3 + H2SO4 =H2SO4 · nSO3
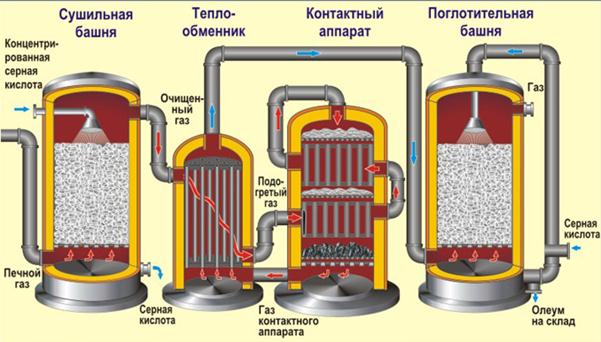
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. Олеум может быть разбавлен водой до серной кислоты нужной концентрации.

Железнодорожные цистерны для перевозки серной кислоты
По ГОСТ 2184-77 различают следующие виды технической серной кислоты:
-контактную (улучшенную и техническую);
-олеум (улучшенный и технический);
-башенную (Основное отличие от контактного метода - способ окисления диоксида серы SO2 до триоксида SO3. В этом методе окисление осуществляется растворенными в серной кислоте оксидами азота. Другое название этого способа - нитрозный метод. Серная кислота, полученная таким образом, несколько дешевле контактной, однако есть ряд недостатков: концентрация башенной кислоты не превышает 78%, кроме того, она содержит примеси оксидов азота и железа);
-регенерированную (Регенерированная серная кислота должна иметь массовую долю моногидрата не менее 91 процента. Следует отметить, что необходимость регенерации серной кислоты обусловлена тем, что на многих производствах активно применяются смеси серной и азотной кислот (в качестве нитрующего агента), и это приводит к образованию больших объемов отработанных кислотных составов. Для того, чтобы вернуть их в производственный цикл, используется регенерация. Это позволяет снижать себестоимость готовой продукции (за счет сокращения расходов).
В настоящее время регенерированная серная кислота широко применяется в различных отраслях промышленности, в частности, она востребована:
- в производстве минеральных удобрений (например, сульфата аммония, суперфосфата),
- в химической промышленности (для выработки сульфата натрия, калия, железа, алюминия, меди, цинка, сульфата бария, бихромата калия; производства кислот; производства простых и сложных эфиров),
- в нефтехимической промышленности (для очистки нефтепродуктов).
Регенерированная серная кислота используется в металлургии, при травлении металлов (меди и железа). Также регенерированная серная кислота может применяться для дубления кож.)
По физико-химическим показателям серная кислота должна соответствовать нормам, указанным в табл.
| Таблица | ||||||||
| Наименование показателя | Норма | |||||||
| Контактная | Олеум | Башенная | Регенерированная | |||||
| Улучшенная | Техническая | Улучшенный | Технический | |||||
| 1-й сорт | 2-й сорт | |||||||
| 1. Исключен (Изм. № 3). | ||||||||
| 2. Массовая доля моногидрата (H2SO4), % | 92,5-94,0 | Не менее 92,5 | Не нормируется | Не менее 75 | Не менее 91 | |||
| 3. Массовая доля свободного серного ангидрида (SO3), %, не менее | - | - | - | - | - | |||
| 4. Массовая доля железа (Fe), %, не более | 0,006 | 0,02 | 0,1 | 0,006 | Не нормируется | 0,05 | 0,2 | |
| 5. Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,05 | Не нормируется | 0,02 | То же | 0,3 | 0,4 | |
| 6. Массовая доля окислов азота (N2O3), %, не более | 0,00005 | Не нормируется | 0,0002 | Не нормируется | 0,05 | 0,01 | ||
| 7. Массовая доля нитро-соединений, %, не более | Не нормируется | 0,2 | ||||||
| 8. Массовая доля мышьяка (As), %, не более | 0,00008 | Не нормируется | 0,00008 | Не нормируется | ||||
| 9. Массовая доля хлористых соединений (Cl), %, не более | 0,0001 | Не нормируется | ||||||
| 10. Массовая доля свинца (Pb), %, не более | 0,001 | Не нормируется | 0,0001 | Не нормируется | ||||
| 11. Прозрачность | Прозрачная без разбавления | Не нормируется | ||||||
| 12. Цвет, см3 раствора сравнения, не более | Не нормируется |
Наименование продукта: Кислота серная контактная, улучшенная
Химическая формула: Н2SO4
Изготовлена по ГОСТ 2184-77
Cтруктурная формула:

Фасовка: наливом в канистрах
Производитель: Россия
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 12160; Нарушение авторских прав?; Мы поможем в написании вашей работы!