
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциостатическая кулонометрия
|
|
|
|
Кулонометрия - электрохимический метод основан на измерении количества электричества, необходимого для превращения анализируемого вещества в ходе его электролитического восстановления или окисления, при условии 100%-ного выхода по току.
Кулонометрия
Измерив количество электричества, израсходованного за время протекания реакции до полного разложения реагирующего вещества, можно определить содержание этого вещества по закону Фарадея.
m=I*t*q,
Электролиз:
1. при контролируемом потенциале – потенциостатическая кулонометрия
2. при контролируемой силе тока – (прямой электролиз- амперостатическая кулонометрия; косвенный электролиз – кулонометрическое титрование).
Значение потенциала рабочего электрода ( РЭ – расположен в электродном пространстве, содержащем определяемое вещество), которое надо задать для определения интересующего вещества, можно установить по уравнению Нернста
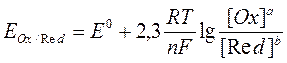
Область применения:
1. Во всех случаях, когда применим электрогравиметрический способ при контролируемом потенциале катода, но не требуется взвешивать продукт реакции.
2. когда образуется осадок, не пригодный для взвешивания или его нет (например, при определение Fe по реакции Fe2+-e-→Fe3+ или As по реакции
H3AsO3 - 2e-→H3AsO4)
3. Для определения органических веществ
4. Удобно применять для определения миллиграммовых количеств (5 – 200мг)
5. Для непрерывного автоматического анализа газа или жидкости (например, определение О2 в газе от 10-4 – 1%)
На Ag катоде:
О2 + 2Н2О +4 е- → 4 ОН-
На Cd аноде:
Cd0-2 е-→ Cd2+
Ag – Cd дают гальванический элемент, ток которого пропорционален СО2; поэтому можно определить СО2 через ΔU на калиброванном сопротивлении.
6. Ошибка определения 0,01 – 3% и зависит более от применяемой аппаратуры и квалификации исполнителя, чем от интервала концентраций.
7. Метод полностью документален, так как требуется запись кривой изменения силы тока во времени.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1290; Нарушение авторских прав?; Мы поможем в написании вашей работы!