
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы лигандов
|
|
|
|
Ион [Co(NH3)6]3+ не имеет неспаренных электронов, поэтому он диамагнитен.
В каждом лиганде присутствует определённое число донорных атомов, т.е. атомов, которые принимают непосредственное участие в связывании с центральным атомом. Число донорных атомов в лиганде характеризует его координационную ёмкость – дентатность. Лиганды, содержащие один донорный атом, называются монодентатными: NH3, H2O, F-, Cl-, Br-, I-; два донорных атома – бидентатными: H2N - CH2 - CH2- NH2 (этилендиамин),
H2N - CH2 – COOH (аминоуксусная кислота; гликоколь).
Когда оба донорных атома бидентатного лиганда связаны с одним и тем же центральным атомом металла и образует кольцевую систему, соединение называется хелатным. Это название происходит от греческого слова chela, которое означает клешню рака или краба. Название хелатный не применяется, если бидентатный лиганд образует мостиковую систему, т.е. два его донорных атома связаны с различными акцепторными центрами(табл.).
Термин «хелатный эффект» обозначает увеличение устойчивости комплексов с полидендатными лигандами по сравнению с комплексами, содержащими монодендатные лиганды. Хелаты – это комплексы, содержащие полидентатные лиганды (не всегда). Хелатный эффект обусловлен не энтальпийной, а энтропийной составляющей энергии Гиббса образования комплекса.
| Тип | Пример | |
| Монодентатный |  Mz+ NH3 Mz+ NH3
| |
| Бидентатный |  NH2 – CH2
Mz+ | NH2 – CH2
Mz+ |
 NH2 – CH2 NH2 – CH2
| хелатный |
| Бидентатный |
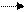  Mz+ H2N - CH2 - CH2 - NH2 Mz+ Mz+ H2N - CH2 - CH2 - NH2 Mz+
| мостиковый |
| Тридентатный |
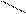   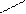 CH2 NH CH2 CH2 NH CH2
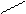 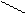 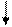 CH2 CH2 CH2 CH2
  NH2 Mz+ NH2 NH2 Mz+ NH2
| хелатный |
Аминоуксусная кислота относится к амбивалентным лигандам, которые содержат различные донорные атомы (N и O). Все биологические лиганды – амбивалентные. Если в раствор этого амбивалентного лиганда ввести Cu2+, то образуется медная соль аминоуксусной кислоты Cu(CH3NH2COO)2, которая практически не диссоциирует в водном растворе на ионы, так как каждый анион соли в результате комплексообразования «привязан с двух сторон» к катиону меди:


 H2C H2N O CO
H2C H2N O CO




 Cu
Cu

 OC O NH2 CH2
OC O NH2 CH2



 Известны тридентатные лиганды: CH2 – CH - CH2 (триаминопропан);
Известны тридентатные лиганды: CH2 – CH - CH2 (триаминопропан);
NH2 NH2 NH2
ֹֹ ׁׁ ֹֹ
NH2- CH2 - CH2- NH- CH2 - CH2- NH2 (диэтилентриамин), которые имеют
ֹֹ ֹֹ ֹֹ
по три аминогруппы и могут занимать три координационных места).
И подидентатные, которые содержат более 3-х донорных атома, например, этилендиаминтетрауксусная кислота (ЭДТА) (шестидентатный лиганд):
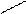
 -OOCCH2 CH2 COO-
-OOCCH2 CH2 COO-
 ֹֹ N – CH2 - CH2 – N ֹֹ
ֹֹ N – CH2 - CH2 – N ֹֹ
-OOCCH2 CH2COO-
ֹֹ ֹֹ
ЭДТА используется при отравлениях тяжёлыми металлами, при определении жёсткости воды.
Размеры лигандов оказывают влияние на устойчивость комплексных ионов. При одном и том же центральном атоме с увеличением радиуса лиганда: F-, Cl-, ClO4- -устойчивость комплексных ионов уменьшается.
Устойчивость КС зависит также от дипольного момента лиганда: чем выше дипольный момент, тем больше прочность комплекса (μH2O=1,84Д; μNH3 =1,50Д). Следовательно, при одном и том же центральном атоме комплексы с водой будут прочнее комплексов с аммиаком.
Реакции комплексообразования. Константы нестойкости и устойчивости комплексов. Разрушение комплексных соединений.
В водных растворах комплексные соединения, как и другие сильные электролиты, диссоциируют с отщеплением ионов внешней координационной сферы:
[Cu(NH3)4]Cl2 → [Cu(NH3)4]2+ + 2Cl-
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 5009; Нарушение авторских прав?; Мы поможем в написании вашей работы!