
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Процесс сгорания бензина
|
|
|
|
Сгорание топлива – это быстрая реакция окисления углеводородов кислородом. При этом образуется вспышка, молекулярные связи разрываются, накопившаяся энергия выделяется в виде теплоты. При сгорании 1кг топлива выделяется следующее количество теплоты: бензин – 44·106 Дж/кг, дизельное топливо – 42·106 Дж/кг, метан – 33,8·106 Дж/кг.
Конечная реакция сгорания водорода и углерода в результате окисления кислородом протекает так:
2Н2 + О2 = 2Н2О; С + О2 = СО2. (3.1)
Горение – это сложный процесс. Факел горящих углеводородов напоминает своеобразный организм, живущий до тех пор, пока в его огненной оболочке, в которую поступает газифицированное топливо и кислород воздуха, происходит правильный обмен веществ. Даже простейшие газообразные метан, этилен, пары бензина сами по себе не «горючи», пока не будут преобразованы до простейших составляющих в виде молекул СО и Н2. При окислении (горении) углеводородная молекула «опускается» на более низкие энергетические уровни и достигает нулевого уровня, когда полностью разваливается на углекислый газ СО2 и воду Н2О.
Очаг горения – это совокупность трех потоков: теплового (энергетического) и двух материальных–окислителя О2 и топлива.
Окисление – это реакция взаимодействия молекул углеводородного топлива с молекулами кислорода. Если температура воздуха достигает требуемого значения, то окисление переходит в процесс горения.
В жидком топливе имеют место легкие, средние и тяжелые молекулы. В процессе распыливания топлива легкие фракции уже являются газифицированными и в окружении кислорода воздуха под действием температуры электрической искры (10000 0С) воспламеняются, образуя начальную зону пламени (бензиновые двигатели). Далее действует принцип цепной реакции. Под влиянием температуры более тяжелые молекулы испаряются, прогреваются, расщепляются на более мелкие (газифицируются) и в упрощенном газообразном состоянии вступают в процесс горения.
У дизеля топливо должно самостоятельно воспламеняться при нагреве его в кислороде воздуха до температуры самовоспламенения 250 – 300 0С. Для надежного пуска и работы дизеля температура в конце такта сжатия должна быть не менее 500 – 600 0С.
Теоретическое количество воздуха, необходимое для сгорания 1кг бензина, определяют из выражения
L0 = 1/0,23(8C/3 + 8H) = 1/0,23(8·0,855/3 + 8·0,145) ≈ 15 кг. (3.2)
В воздухе 23 % O2; 1кг бензина содержит 0,855 кг. С и 0,145 кг. Н.
Коэффициент избытка воздуха – это отношение действительно поступившего количества воздуха в цилиндр к теоретически необходимому:
α = LД/LO, идеал – LД = LО => α = 1
Если α > 1, смесь бедная; α < 1, – богатая.
Используя формулу Менделеева - Клапейрона PV = mRT, можно определить массу воздуха, поступившего в цилиндр, и требуемое количество топлива.
Процесс сгорания в координатах Р – φ изображен на рис. 3.1 (φ – угол поворота коленчатого вала). Примерно за 20 – 30 градусов до ВМТ подаётся искра (10000 0С), горючая смесь воспламеняется, кривая сгорания отделяется от кривой сжатия. У двигателя с искровым зажиганием процесс сгорания можно условно разбить на три фазы: 1 – начальный период горения (сгорает 6 – 8 % топлива от начала подачи искры до начала сгорания топлива и повышения давления); 2 – основная фаза горения (80 % топлива); 3 – догорание.
При нормальном процессе сгорания воспламенение свежих порций рабочей смеси и перемешивание фронта пламени по камере сгорания происходит вследствие передачи тепла под действием теплопроводности и лучеиспускания.
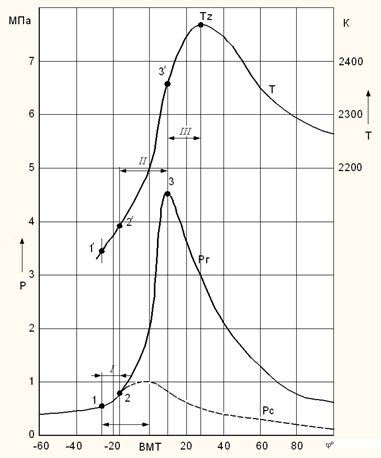
Рис. 3.1. Изменение давления газов в цилиндре (Pг) и температуры (Т) в бензиновом двигателе:
1. – начало подачи искры; 2. – отрыв линии сгорания от линии сжатия (начало видимого сгорания); 3. – максимальное давление сгорания
По анализу изменения давления во второй фазе сгорания судят о жесткости процесса сгорания (скорости повышения давления). Двигатель дожен работать мягко, без стуков с плавным повышением давления.
Для бензиновых ДВС жёсткость процесса сгорания (С =ΔР/Δφ, МПа/градус) С = 0,1 – 0,2 МПа/градус. Жесткость сгорания – это приращение давления на один градус поворота коленчатого вала двигателя.
Нормальный процесс сгорания протекает со скоростью 20 – 50 м/с. В процессе детонации скорость сгорания достигает 2 – 3 тыс. м/с. На осциллограмме процесс сгорания (в зоне третьей фазы) наблюдается в виде затухающих острых пиков. Частота вибрации давления равна частоте слышимых стуков. Звонкие металлические стуки являются результатом отражения ударных волн от стенок камеры сгорания.
На детонационное сгорание топлива влияют:
1. Степень сжатия (повышение степени сжатия ускоряет детонацию).
2. Угол опережения зажигания (раннее зажигание – усиливает детонацию).
3. Сорт топлива (октановое число меньше, детонация больше).
4.Частота вращения коленчатого вала (с уменьшением частоты детонация возрастает).
Причиной детонации является образование перекисей. Кислород при высокой температуре внедряется в углеводородную молекулу топлива, повышая её способность к самовоспламенению. Детонационному (взрывному) сгоранию подвергается та часть горючей смеси, которая должна сгореть в последнюю очередь. Перекиси накапливаются в несгоревшей части рабочей смеси и при достижении критической концентрации распадаются со взрывом и выделением большого количества тепла, активизируя всю рабочую смесь.
Признак детонации – чёрный дым. Его причиной является заброс несгоревшего топлива в зону горения, где нет кислорода. При детонации ударная волна отражается от стенок цилиндра с частотой 2000 – 3000 Гц, при этом возникают металлические стуки. Давление в цилиндре резко изменяется. Мощность двигателя падает, температура в цилиндре возрастает. Для устранения детонации зажигание устанавливают позже. В современных автомобилях это выполняется автоматически. В блоке цилиндров установлен датчик детонации. При появлении детонациисигнал с датчика передается на бортовой компьютер, который при помощи исполнительного механизма автоматически уменьшает угол опережения зажигания, уменьшая давление, температуру в камере сгорания и детонацию.
Способность бензина противостоять его детонационному (взрывному) сгораниюхарактеризуется октановым числом (чем выше – тем лучше)
В прошлом столетии для повышения октанового числа бензинов применяли этиловую жидкость. Этиловая жидкость (Р–9) содержит тетраэтилсвинца Рв(С2Н5)4 54 %, бромистого этила С2 Н5Вr 40 %, хлористого нафталина 6 %. Добавка 1 см3 этиловой жидкости на 1 кг бензина повышает его октановое число, например, с 80 до 90. Наличие этиловой жидкости в бензине при его сгорании задерживает образование перекисей углеводородов, отдаляя их накопление до критической концентрации и начала взрывного сгорания или детонации. При высокой температуре и давлении молекулярный кислород внедряется в молекулу углеводорода по С-Н связи, образуя перекись с повышенной энергией и способностью самовоспламеняться и сгорать со взрывом. Этилированный бензин ядовит, по новому ГОСТ 51105–97 его использование запрещено, так как он загрязняет атмосферу, ухудшает здоровье человека, разрушает нейтрализаторы выхлопных газов.
Октановое число бензинов можно увеличить следующими способами:
1. Внедрением современных технологий переработки нефтяных фракций (крекинг-процесс и риформинг). При крекинге крупные молекулы расщепляются на мелкие, при риформинге видоизменяется их строение (молекула становиться компактной – кольцевой, разветвленной). Стойкость к окислению и самовозгоранию объясняется тем, что молекула принимает форму «круговой обороны» (арены, цикланы).
2. Применением высокооктановых добавок (изооктана, алкилбензола).
3. Применением антидетонационных присадок (этиловой жидкости на основе тетраэтилсвинца Pb(CH5)4, метилтретбутилового эфира CH3ОC4H9 и композиций на основе марганца [С5Н5Мg(СО)3 и железа].
Кроме детонационного сгорания возможно и калильное зажигание. Под калильным зажиганием понимают воспламенение рабочей смеси от раскаленного тела, например электрода свечи, клапана. Калильное зажигание возможно даже после выключения зажигания (двигатель продолжает работать). Причиной данного нарушения могут быть нагретые поверхности клапана или свечи. Например, свеча А-17ДВ, установленная вместо требуемой А-20ДВ, может вызвать калильное зажигание. Свеча А-20ДВ более «холодная», лучше отводит теплоту и её установка устранит калильное зажигание.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1629; Нарушение авторских прав?; Мы поможем в написании вашей работы!