
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема «Лигандообменные равновесия и процессы. Химия гемоглобина»
|
|
|
|
Комплексные соединения
Комплексные соединения составляют наиболее обширный и разнообразный класс химических соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками (хлорофилл, гемоглобин), витаминами (В12 –комплекс кобальта) и другими веществами (инсулин –комплекс цинка, платинол –комплекс платины), играющими роль ферментов или выполняющими специфические функции в обмене веществ.
Часто при получении лекарственных препаратов на основе фармакологически активных комплексных соединений удается понизить токсичность, как металла, так и лигандов, связанных в комплексе, и модифицировать в желаемом направлении как биологическую активность. Так, весьма ядовитый КСN теряет свою токсичность при связывании в ферроцинид (желтая кровяная соль) или феррицианид (красная кровяная соль) калия.
Координационная теория Вернера. Строение комплексных соединений: центральный атом, лиганды, координационное число
Впервые свойства и строение комплексных соединений были объяснены в рамках координационной теории, предложенной швейцарским химиком А. Вернером (1892), хотя широкое признание данной теории получила лишь после создания электронной теории валентности (см задачу № 2, стр. 85 метод пособие Жолнина).
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе. Но, однако, в настоящее время четкого общепризнанного определения комплексных соединений не существует. Это обусловлено разнообразием комплексных соединений и их характерных свойств.
Координационную теорию Вернера рассмотрим на примере:
K3 [Fe(CN)6]
внешняя и внутренняя сфера
Согласно данной теории, центральный атом или ион, в большинстве случаев в форме катиона (обычно положительно заряженный), координирует (т.е. близко располагает) вокруг себя некоторое число анионов или молекул, которые называются лигандами, (или аддендами – старое название). Простые положительно заряженные катионы в роли лигандов не выступают. Число лигандов, окружающих центральный ион, называется координационным числом (КЧ). Центральный атом вместе с координированными лигандами образуют внутреннюю координационную (т.е. комплексную) сферу, которую при записи формулы заключают в квадратные скобки. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
В подавляющем большинстве комплексных соединений в качестве комплексообразователя выступают ионы переходных металлов, хотя известны комплексные соединения практически для всех элементов.
Координационное чис ло может иметь значения 2; 3; 4; 5; 6 и т. д. вплоть до 12 (например, для некоторых соединений редкоземельных металлов). Наиболее часто встречаются координационные числа 2; 4; 6. Координационные числа выше 8 встречаются реже.
Значение кч комплексообразователя зависят от многих факторов:
- от природы лиганда и его электронных свойств;
- агрегатного состояния;
- концентрации компонентов;
- температуры раствора;
- но обычно оно равно удвоенному заряду иона комплексообразователя.
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно – акцепторное происхождение и является ковалентной. Роль акцептора электронов выполняет комплексообразователь, имеющий свободные орбитали и достаточно большой положительный заряд ядра, а роль донора выступают лиганды, способные отдавать комплексообразователью неподеленную электронную пару. Ионы, находящиеся во внешней сфере, связаны с комплексным ионам в основном силами электростатическогого взаимодействия.
Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4].
Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов: [AI3+(OH-)4]z -? z=+3+4¬(-1)=-1, т.е [AI(OH)4]-.
Наоборот, зная заряд комплексного иона и заряды лигандов [AI(OH)4]-), можно определить степени окисления комплексообразователя: х+ (-1)ž4= -1; х= +3. Степень окисления алюминия +3.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения. В приведенном примере внутренней координационной сферой является [AI(OH)4]-. Заряд аниона в этом случает компенсирует катион К+, находящиеся во внешней координационной сфере.
Классификация лигандов
В качестве лигандов выступают молекулы или ионы, содержащие донорные атомы (наиболее распространенные N, Р, О, галогены), способные отдавать комплексообразователю неподеленную электронную пару.
Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения, называется координационной емкостью (дентатностью) лиганда. Она определяется числом электронных пар лиганда, которые участвуют в образовании координационной связи с центральным атомом.
По числу связей, образуемых лигандами с комплексообразователем, лиганды делятся на моно-, ди- и полидентатные::
1) К монодентатным относятся анионы F-, СI-, Вг-, I-, H-, CN-, NO-, SCN- и т.д., нейтральные молекулы (NH3, амины, например, первичные RNH2 (R — органический радикал), молекулы воды и т. д.), имеющие только один донорный атом.
2) К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы, способные быть донором двух электронных пар. Например,
 Молекула этилендиамина Молекула этилендиамина
 Дианион щавелевой кислоты Дианион щавелевой кислоты
| 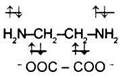
|
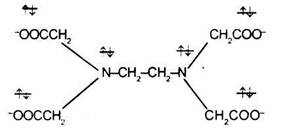
3) Кполидентатным лигандам можно отнести 6-дентатный лиганд тетраанион этилендиаминтриуксусной кислоты (ЭДТА):
Номенклатура комплексных соединений.
Название комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже
Названия комплексных соединений образуются аналогично названиям обычных солей с той лишь разницей, что указываются лиганды и степень окисления центрального атома. К названиям лигандов-анионов добавляют суффикс -о (сульфато-, хлоро-, бромо-, циано-, и т.д.). Наиболее важные лиганды-молекулы: Н2О - аква, NН3 - аммин, СО - карбонил. Число лигандов каждого рода указывают греческими числительными: ди-, три-, тетра- и т.д. Если комплексная частица является анионом, то ее название заканчивается суффиксом –«ат» (примеры: цинкат, хромат, феррат).
Если присутствуют несколько лигандов, они перечисляются в алфавитном порядке и префиксы не изменяют этот порядок, например [CrCI2(H2O)4]+- тетрааквадихлорохром (III)-ион. (хотя р екомендуют сначала указывать название отрицательно заряженных лигандов, а затем названия нейтральных молекул).
Классификация комплексных соединений
Существует несколько систем классификации комплексных соединений, которые основываются на различных принципах.
1. По знаку заряда комплекса.

Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.
2. По принадлежности комплексного соединения к определенному классу соединений

Есть и вещества, не диссоциирующие на ионы, т.е. неэлектролиты
3. По природе лиганда.
- аквакомплексы (лигандом выступает вода),
- аммиакаты (лигандом выступает аммиак),
- ацидокомплексы (анионы - кислоты),
- гидроксокомплексы (ОН-),
- комплексы с макроциклическими лигандами, внутри которых размещается центральный атом (хлорофилл, гемоглобин, цианокобаламин, см. стр. 316, Попков В.А.).
4. По внутренней структуре комплекса:
- моноядерные – если комплекс содержит только один атом металла – комплексообразователя (пример, PdCI4 – имеет один атом палладия);
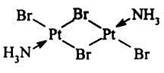
- многоядерные или полиядерные – если он содержит два или более атомов металла (комплекс платины [Pt2(NH3)2CI4] – содержащий два атома платины.
 Если полиядерные комплексы содержат атомы металла одинаковой химической природы, то они называются гомометаплическими: Если полиядерные комплексы содержат атомы металла одинаковой химической природы, то они называются гомометаплическими:
| 
|
 Если же в полиядерном комплексе имеются атомы металла-комплексообразователя разной химической природы, то такие комплексы называются гетерометаллическими. Так, из двух биядерных комплексов: Если же в полиядерном комплексе имеются атомы металла-комплексообразователя разной химической природы, то такие комплексы называются гетерометаллическими. Так, из двух биядерных комплексов:
| 
|
Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по- разному относительно друг друга.
.
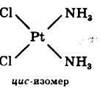

Геометрические изомеры комплексных соединений отличаются не только по физическим и химическим свойствам, но и биологической активностью. Цис- изомер Pt(NH3)2CI2 имеет ярко выраженную противоопухолевую активность, а транс-изомер – нет.
Устойчивость комплексных соединений в растворах
Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Поэтому с помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы.
Лиганды, находящиеся по внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации (протекает по типу слабых электролитов). Например, диссоциацию комплекса [Ag(NH3)2]Cl имеет вид:

Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами
Диссоциация ионов [Ag(NH3)2]+, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:

С учетом активности ионов уравнение констант нестойкости принимает следующий вид:
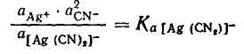
Полученная константа Ка называется термодинамической константой нестойкости.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости. Так, среди однотипных соединений, обладающих различными значениями констант нестойкости
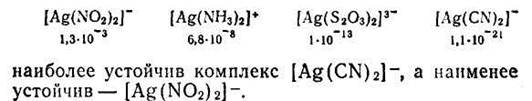
Величина, обратная константе нестойкости, называется общей или суммарной константой устойчивости. Следовательно,
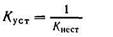
Последняя также характеризует устойчивость комплексных ионов.
Если ионизация комплексных ионов происходит по ступеням, то константы равновесия этих промежуточных реакций называются промежуточными или ступенчатыми константами нестойкости. Например, для комплексов кадмия с цианид-ионами известны следующие промежуточные константы нестойкости, которые нумеруются в порядке возрастания числа лигандов, связанных с центральным атомом комплекса, ионизирующего на одну ступень:
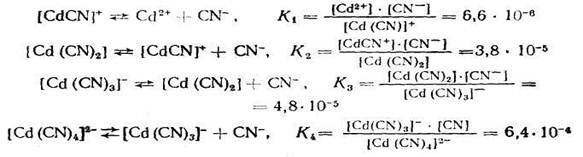
Однако практически пользуются общей суммарной константой нестойкости, равной произведению промежуточных констант нестойкости:
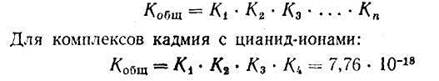
Хелатные комплексы
Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными (многозубыми) лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру (т.е. ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака). В связи с этим такие комплексные соединения получили названия хелатов.
Хелаты - устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры. Простейшими хелатообразующими лигандами. являются бидентатные лиганды, образующие две связи с центральным атомом, например, глицин:
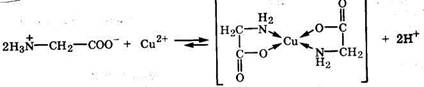 К нест. =5,6ž10-16
К нест. =5,6ž10-16
Конкуренция за лиганд или за ион-комплексообразователь.
Процессы образования комплексного соединения иона металла с каждым из лигандов являются конкурирующими: преобладающим будет процесс, который приводит к образованию наиболее прочного (т. е. с наименьшей константой нестойкости) комплексного соединения. Заключение о сравнительной прочности комплексных соединений на основании величин констант нестойкости можно делать только для однотипных соединений.
| Конкуренция за лиганд | Конкуренция за ион-комплексообразователь |
| Допустим, в растворе в равных концентрациях окажутся ионы Zn2+, Ni2+ и CN-ионы. В этом случае преимущественно образуется тетрацианоникколат- ион, а не тетрацианоцинкат- ион, так как Kнест([Zn(CN)4]2-) > Kнест ([Ni(CN)4]2-). В этом случае объектом конкуренции является цианид-ион, а конкурирующими частицами — ионы цинка и никеля. | Если смешать вещества таким образом, что в растворе в равных концентрациях окажутся ионы Zn2+, NH3, CN-ионы, то преимущественно образуется тетрацианоцинкат-ион, а не тетраамминцинкат-ион, так как Kнест ([Zn(CN)4] 2-) < Kнест ([Zn(NH3)4]2-). В этом случае объектом конкуренции является ион цинка, а конкурирующими частицами — цианид-ионы и молекулы аммиака, конкуренцию выигрывают цианид-ионы. |
Тема «Гетерогенные равновесия и процессы»
Гетерогенные процессы – это процессы на границе раздела фаз.
Фазы – отдельные однородные части гетерогенный системы, отграниченные друг от друга поверхностью раздела.
К гетерогенным относят, прежде всего, процессы, связанные с образованием и растворением малорастворимых веществ ионного типа. При контакте таких веществ (сильных электролитов) с водой часть ионов переходит в раствор и устанавливается динамическое равновесие между гидратированньши ионами электролита в водном растворе и кристаллами твердой фазы — гетерогенное равновесие.
Раствор, находящийся в динамическом равновесии с твердой фазой (т.е. с осадком), называют насыщенным.
Процесс растворения – обратимый процесс, он сопровождается процессом осаждения. Например:
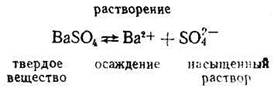
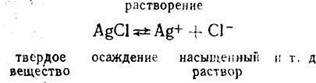
 При установившемся равновесии и постоянной температуре (t) величину поверхности твердой фазы можно считать постоянной (равной 1) и, используя закон действия масс, можно записать, что v1= k1 т. е. скорость растворения осадка при t = const зависит только от природы данного вещества.
При установившемся равновесии и постоянной температуре (t) величину поверхности твердой фазы можно считать постоянной (равной 1) и, используя закон действия масс, можно записать, что v1= k1 т. е. скорость растворения осадка при t = const зависит только от природы данного вещества.
Скорость обратного процесса v2, т. е. скорость осаждения ионов на поверхности твердой фазы (учитывая, что поверхность постоянна и равна 1, t = const), будет равна произведению активностей данных ионов. Следовательно,

Так как при установившемся равновесии скорости реакций растворения и осаждения равны v1= v2 ), то отсюда:
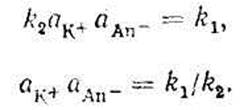



 Константы скорости k1, и k2 при постоянной температуре – величины постоянные, значит, и отношение их есть величина постоянная. Поскольку данная величина характеризует собой свойство веществ растворяться и равна произведению активности ионов в растворе, она называется произведением растворимости (ПРа или в настоящее время принято обозначить через Кs – константа растворимости).
Константы скорости k1, и k2 при постоянной температуре – величины постоянные, значит, и отношение их есть величина постоянная. Поскольку данная величина характеризует собой свойство веществ растворяться и равна произведению активности ионов в растворе, она называется произведением растворимости (ПРа или в настоящее время принято обозначить через Кs – константа растворимости).
Итак, произведение растворимости или Кs— это произведение активностей ионов в насыщенном растворе малорастворимого электоолита t= const). Например,
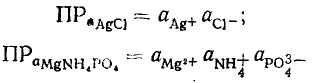



 Поскольку активность ионов равна произведению молярной концентрации его на коэффициент активности, то
Поскольку активность ионов равна произведению молярной концентрации его на коэффициент активности, то
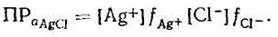
У малорастворимого электролита при ПРа не более 10-8 в насыщенном растворе концентрации ионов малы, значит силы межионного взаимодействия также малы (fAg+ =fCI- = I) и практически не оказывают влияния на подвижность ионов. Следовательно, приближенное уравнение произведения растворимости

В общем случае для малорастворимого электролита константа растворимости Ks определяется стехиометрическим произведением концентраций ионов, посылаемых в раствор даннымэлектролитом:
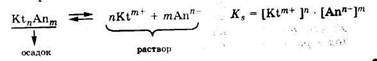
Чем меньше Ks, тем соль меньше растворяется.
Активности ионов нельзя заменять их концентрациями:
а) когда наряду с малорастворимыми электролитами (AgCl, BaSО4 и т. д.) в растворе присутствуют сильные электролиты в достаточно высоких концентрациях, повышающие ионную силу раствора, т. е. резко изменяющие величину коэффициента активности;
б) когда коэффициент активности не равен единице, т. е. для хорошо растворимых электролитов.
Насыщенные, ненасыщенные и пересыщенные растворы
Насыщенные (произведение активностей ионов малорастворимого электролита достигает значения его произведения растворимости при данной температуре), ненасыщенные (если ионное произведение активностей меньше произведения растворимости) и пересыщенные (если ионное произведение активностей больше произведения растворимости, из которого может выделяться часть растворенного вещества в осадок) растворы электролита характеризуются следующими соотношениями между концентрациями в них ионов и константой растворимости:
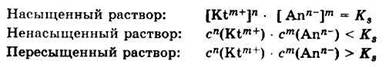
Использовать константы растворимости для сравнения растворимости можно только в том случае, если формульные единицы веществ содержат одинаковое число катионов и анионов. Нельзя, например, сравнивать растворимость AgCl, Ag2SO4 и Ag3PO4, используя для этих целей только величины Ks. Сравнивать разнотипные электролиты можно только по их равновесной концентрации в насыщенном растворе, которую часто называют молярной растворимостью (s, моль/л).
В общем виде растворимость электролита типа АаВb вычесляют по формуле:
s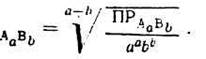
Так, для Са3(РО4)2 растворимость равна: 
s 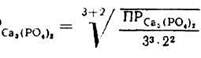
Величина Ks характеризует растворимость электролита при данной температуре и зависит от природы малорастворимого электролита и растворителя.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 8283; Нарушение авторских прав?; Мы поможем в написании вашей работы!