
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение фтора
|
|
|
|
Нахождение в природе. История получения фтора
Фтор – распространенный элемент в природе, содержание фтора в земной коре составляет» 0,06 мас. %. В свободном состоянии фтор не встречается. Важнейшими минералами, содержащими фтор, являются CaF2 – флюорит (плавиковый шпат) (Прибайкалье), Na3AlF6 – криолит, 3Са3(PO4)2 × CaF2 – фторапатит (Кольский полуосторов).
История открытия фтора связана с минералом флюоритом (плавиковым шпатом) CaF2. В давние времена флюорит использовался в металлургии для понижения температуры плавления руды и шлаков.
В 1771 году обработкой флюорита серной кислотой шведский химик Карл Шееле приготовил кислоту, которую он назвал «плавиковой»:
CaF2 + H2SO4 (конц.) ® 2 HF + СaSO4.
Французский ученый Антуан Лавуазье предположил, что в состав этой кислоты входит новый химический элемент, который он предложил назвать «флюорем», что в переводе означает «текущий» (Лавуазье считал, что плавиковая кислота – это соединение флюория с кислородом, ведь, по мнению Лавуазье, все кислоты должны содержать кислород). Однако выделить новый элемент он не смог. За новым элементом укрепилось название «флюор».
Длительные попытки выделить этот элемент в свободном виде не привели к успеху. Многие ученые, пытавшиеся получить его в свободном виде, погибли при проведении таких опытов или стали инвалидами. Это и английские химики братья Т. и Г. Ноксы, и французы Жозеф-Луи Гей-Люссак и Луи Жак Тенар, и многие другие. Сам Гемфри Дэви, первым получивший в свободном виде натрий, калий, кальций и другие элементы, в результате экспериментов по получению фтора электролизом отравился и тяжело заболел.
В 1816 году для нового элемента было предложено другое название – фтор (от греч. phtoros – разрушение, гибель). Это название элемента принято только в русском языке, французы и немцы продолжают называть фтор fluor, англичане –fluorine. Получить фтор в свободном виде не смог и такой выдающийся ученый, как Майкл Фарадей.
Только в 1886 году французский химик Анри Муассан, используя электролиз жидкого фтороводорода HF, охлажденного до температуры – 23°C (в жидкости должно содержаться немного фторида калия KF, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, чрезвычайно реакционноспособного газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины (Pt) и иридия (Ir). При этом каждый грамм полученного фтора «съедал» до 6 г платины. Позднее Муассан стал использовать значительно более дешевый медный электролизер.
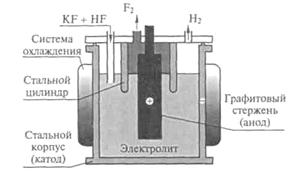 1. Фтор получают электролизом расплава KF × HF (при 250 ºС) или KF × 2HF (при 100 ºС). Процесс электролиза проводят в медных, никелевых или стальных электролизерах, катоды – медные или стальные, аноды – угольные (данные материалы не разрушаются фтором при температуре электролиза). Стенки электролизера покрываются плотной пленкой фторида, препятствующей коррозии. Для предотвращения взрыва при взаимодействии фтора с выделяющимся водородом в электролизере установлен стальной цилиндр, разделяющий катодное и анодное пространство (рис. 1).
1. Фтор получают электролизом расплава KF × HF (при 250 ºС) или KF × 2HF (при 100 ºС). Процесс электролиза проводят в медных, никелевых или стальных электролизерах, катоды – медные или стальные, аноды – угольные (данные материалы не разрушаются фтором при температуре электролиза). Стенки электролизера покрываются плотной пленкой фторида, препятствующей коррозии. Для предотвращения взрыва при взаимодействии фтора с выделяющимся водородом в электролизере установлен стальной цилиндр, разделяющий катодное и анодное пространство (рис. 1).
Рис. 1. Схема электролизера для получения фтора
Электролизу подвергается HF, а KF обеспечивает электрическую проводимость расплава:
3 HF ® H2F+ + HF2–
А: HF2– – 2е– ® F2 + 2HF
К: H2F+ + 2е– ® Н2 + 2HF
2. В лабораторных условиях фтор получают разложением высших фторидов металлов (церия, марганца):
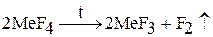 , где Ме = Ce, Mn
, где Ме = Ce, Mn
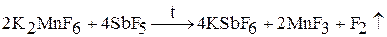
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 11448; Нарушение авторских прав?; Мы поможем в написании вашей работы!