
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Н Нстепень окисления -1
|
|
|
|
NH2 ОН – гидросиламин
Н ●●


 N – О валентность (N) = III,
N – О валентность (N) = III,
Донор электронной пары.
Белое кристаллическое вещество, гигроскопичен, летуч, легкоплавок (плав. 35 0С).
Получение:
При восстановлении азотной кислоты атомарным водородом при электролизе:
НNО3 + 6H = NН2ОН + 2H2O
А также: 2NО + 3H2 = 2NН2ОН (катализатор – платина)
Свойства:
С водой смешивается в любых отношениях. Является слабым основанием:
NН2ОН + H2O = NН2ОН . H2O ↔ NН3ОН+ + ОH-
С кислотами дает соли:
NН2ОН + HCl = [NН3ОН] Cl
Хлорид гидроксиламмония
Хлорид гидроксиламиния
За счет N-1 - сильный восстановитель (в ОН- - среде)
Слабый окислитель (в Н+)
Диспропорционирует.
Вос-ль: 2NH2ОH + I2 + 2КОН = N2 + 2КI + 4H2O
Ок-ль: 2NH2ОH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 +(NH4)2SO4 + 2H2O
Дисп-ет: 3NH2ОH = NН3 + N2 + 3H2O (выше 1000С)
ЗАКОНОМЕРНОСТИ:
В ряду:
Н2О2 - NH2ОH - N2H4 окислительная активность падает,
Восстановительная возрастает.
Для Н2О2 наиболее характерны окислительные свойства,
Для N2H4 - восстановительные,
NH2ОH в щелочной среде – сильный восстановитель, в кислой – окислитель.
МОЧЕВИНА (карбамид)
(NH2)2CO – б/цв крист. в-во, Р в воде.
 Н Н
Н Н

 N – С - N
N – С - N
║
Н О Н
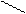 Получение: 2NH3 + CO2 = (NH2)2CO+ H2O
Получение: 2NH3 + CO2 = (NH2)2CO+ H2O
Свойства: При кипячении растворов мочевины с кислотами или щелочами она гидролизуется. Эта реакция медленно идет и в почвенных растворах.
(NH2)2CO+ H2O = 2NH3 + CO2
Мочевина – конечный продукт белкового обмена у многих беспозвоночных, большинства позвоночных и человека.
Применяется как удобрение (не изменяет рН почвы) и для подкормки скота. (входит в состав жвачек)
Также для синтеза пластмасс, фармацевтических препаратов.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!