
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Kalii bromidum (ГФ Х ст.360)
|
|
|
|
Калия бромид
NaBr
Natrii bromidum (ГФ Х ст. 425)
Натрия бромид
KCl
Kalii chloridum (ГФ Х ст. 362)
Калия хлорид
NaCl
Натрия хлорид
Натрия и калия бромиды.
Natrii chloridum (ФС – 42-2572-95)
Получение и нахождение в природе:
Натрия хлорид очень широко распространен в виде каменной соли, а также в растворенном состоянии содержится в воде морей и озер.
В России имеются богатейшие месторождения натрия хлорида на Урале (Соль - илецк), в Пермской области (Соликамск, Усолье, Березники), на Украине (около Артемовска), в Волгоградской области (озера Эльтон и Баскунчак), в Казахстане.
Из воды озер и морей натрия хлорид получают выпариванием, однако при этом остаются примеси.
С помощью хлорида бария осаждают сульфаты и фосфаты. Раствор натрия хлорида отделяют от осадка и обрабатывают избытком карбоната натрия, для осаждения примесей солей магния, кальция и бария. Раствор отделяют от осадка и нейтрализуют хлористводородной кислотой до удаления карбонатов. Затем раствор упаривают и прокаливают при температуре 200 градусов.
Источником получения калия хлорида являются минералы:
- сильвинит (KCl•NaCl)
- карналит (KCl•MgCl2•6H2O)
Из них отделяют калия хлорид методом флотации, а затем очищают как и натрия хлорид.
Бромиды натрия и калия получают из бромисто-бромного железа, нагревают до кипения и прибавляют карбонат натрия или калия.
 4Na2CO3 8NaBr
4Na2CO3 8NaBr
 Fe3Br8 + + 4H2O + 2Fe(OH)3↓ + Fe(OH)2↓ + 4CO2↑
Fe3Br8 + + 4H2O + 2Fe(OH)3↓ + Fe(OH)2↓ + 4CO2↑
4K2CO3 8KBr
Углекислый газ летуч, осадки отфильтровывают, а из фильтрата после выпаривания выкристаллизовывается натрия бромид или калия бромид.
Описание:
По физическим свойствам хлориды и бромиды представляют собой кристаллические порошки белого цвета. Хорошо растворяются в воде, растворимость их в спирте различна – калия хлорид практически нерастворим в спирте, натрия хлорид и бромид в спирте мало растворимы. Все имеют соленый вкус. Натрия бромид более гигроскопичен, чем другие галогениды. Бромиды светочувствительны.
Подлинность:
Подлинность препаратов натрия и калия хлоридов, бромидов определяется реакциями на катионы натрия и калия и соответствующие анионы: на хлорид и бромид.
Реакции на натрий:
1. Соль натрия, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя окрашивается в желтый цвет.
2. При добавлении к раствору соли натрия нескольких капель раствора цинкуранилацетата в разбавленной уксусной кислоте выпадает кристаллический осадок желтого цвета:
Na+ + Zn[(UO2)3(CH3COO)8 + CH3COOH + 9H2O → Na[Zn(UO2)3(CH3COO)9]•9H2O↓ + H+
Реакции на калий:
1. Бесцветное пламя горелки в присутствии катиона калия окрашивается в фиолетовый цвет, при рассматривании через синее стекло - в пурпурно-красный цвет.
2. Виннокаменная кислота в присутствии ацетата натрия осаждает из солей калия белый кристаллический осадок гидротартрата калия, растворимый в кислотах и щелочах:
H2C4H4O6 + KCl + CH3COONa →KHC4H4O6↓ + NaCl + CH3COOH
Реакция идет в присутствии спирта на холоду.
3. При действии на соли калия раствором кобальтинитрита натрия в присутствии разбавленной уксусной кислоты выпадает желтый кристаллический осадок двойной соли гексанитрокобальтата калия-натрия:
Na3[Co(NO2)6] + 2KCl → K2Na[Co(NO2)6]↓ + 2NaCl
Мешают катионы аммония.
Реакции на анионы:
1. Реакция осаждения раствором нитрата серебра:
Все галогениды в присутствии азотной кислоты дают творожистые осади белого или желтоватого цвета:
 Cl- AgCl↓ белый
Cl- AgCl↓ белый
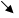 + AgNO3 + NO3-
+ AgNO3 + NO3-
Br- AgBr↓ слегка желтоватый
Отличаются они по различной растворимости в растворе аммиака и растворе углекислого аммония:
AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
AgCl + 2(NH4)CO3 → [Ag(NH3)2]Cl + 2H2O + 2CO2↑
Бромид серебра не растворим в карбонате аммония и трудно растворим в разбавленных растворах аммиака, легко – в концентрированном (25%) растворе аммиака:
AgBr + 2NH4OH → [Ag(NH3)2]Br + 2H2O
2. Окислительно-восстановительная реакция определения бромидов:
Методика: к подкисленному раствору бромидов прибавляют хлороформ и соответствующий окислитель.
ГФ Х рекомендует для открытия бромидов использовать раствор хлорамина в кислой среде. Хлороформный слой окрашивается желтый цвет или красно-бурый:





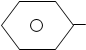
 Na
Na





 SO2N + 2HCl SO2NH2 +
SO2N + 2HCl SO2NH2 +
Cl
+ Cl2 + NaCl
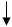 2NaBr + Cl2 → Br2 + 2NaCl
2NaBr + Cl2 → Br2 + 2NaCl
в хлороформ
Чистота:
При установлении доброкачественности ГФ Х допускает присутствие сульфатов, тяжелых металлов, железа, мышьяка в пределе эталона.
В хлориде натрия не допускаются соли калия и наоборот, так как эти примеси являются антагонистами по фармакологическому действию.
В бромидах не допускается примесь солей бария, кальция, броматов, иодидов.
Натрия хлорид не должен содержать солей магния, бария, калия. Соли аммония в натрия хлориде в пределах эталона, в калия хлориде – недопустимая примесь. В хлориде натрия допускаются соли кальция. Определяется микробиологическая чистота.
Количественное определение:
1. Натрия и калия хлориды и бромиды определяются по ГФ Х методом Мора:
Метод прямого титрования.
Пригоден для определения хлоридов, бромидов в нейтральной и слабощелочной среде.
Рабочим титрованным раствором является 0,1М раствор нитрата серебра, индикатор – хромат калия:
 NaCl + AgNO3 AgCl↓ + NaNO3
NaCl + AgNO3 AgCl↓ + NaNO3
0,1Н
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3
В кислой среде осадок хромата серебра растворяется, в щелочной среде со щелочью вступает в реакцию нитрат серебра, с образованием бурого осадка гидроксида серебра.
Мr. N • Э T • V • K • 100
Э = ----- Т = ------ Х% = --------------------
1 1000 а
Возможные метод количественного определения:
2. Метод Фольгарда:
Метод обратного титрования (хлориды, бромиды, иодиды).
В качестве индикатора используют железоаммонийные квасцы. Рабочими растворами являются 0,1н растворы нитрата серебра и роданида аммония.
Определение проводят в азотнокислой среде.
Точную навеску препарата растворяют в воде, прибавляют избыток 0,1н раствора нитрата серебра, титруют 0,1н раствором роданида аммония, в присутствии азотной кислоты и железоаммонийных квасцов до кроваво-красного окрашивания.
HNO3
 NaBr + AgNO3 AgBr↓ + NaNO3
NaBr + AgNO3 AgBr↓ + NaNO3
Изб. 0,1н
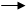 AgNO3 + NH4CNS AgCNS↓ + NH4NO3
AgNO3 + NH4CNS AgCNS↓ + NH4NO3
Изб.
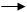 3NH4CNS + Fe(NH4)(SO4)2 Fe(CNS)3 + 2(NH4)2SO4
3NH4CNS + Fe(NH4)(SO4)2 Fe(CNS)3 + 2(NH4)2SO4
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 15276; Нарушение авторских прав?; Мы поможем в написании вашей работы!