
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Первое начало термодинамики ничего не говорит о направлении протекания процесса
|
|
|
|
Первое начало термодинамики ничего не говорит о направлении протекания процесса. О направлении протекания процессов говорит второе начало термодинамики.
Второе начало термодинамики:
Теплота не может переходить от менее нагретого тела к более нагретому телу.
Рассмотрим два резервуара в изолированной системе.
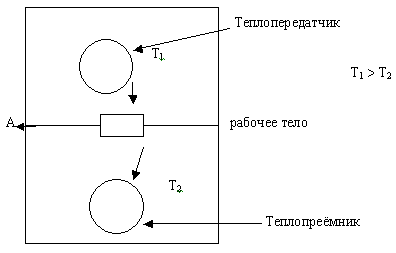
По мере перекачки энергии горячий резервуар охлаждается, а холодный нагревается. Следовательно, разность температур резервуаров уменьшается в течение всего периода времени, когда совершается работа.
Это означает, что количество энергии, которое может быть потрачено на работу (оно зависит от разности температур), должно всё время уменьшаться.
Энергия, которая уже перешла от теплопередатчика к приёмнику и превратилась в работу, называется связанной, или недоступной энергией, так как превратиться в работу она не может.
Для обозначения этой связанной, или недоступной, энергии Клаузиус ввёл следующую термодинамическую функцию, которую назвал энтропией  S (превращение).
S (превращение).
Энтропия - отношение теплоты к температуре, при которой происходит переход энергии
S = Q/T Дж/моль к.
Физический смысл энтропии настолько сложен, что долгое время не был объяснён. Объяснил его Больцман. Он назвал энтропию термодинамической вероятностью существования системы, то - есть данному макросостоянию системы отвечает множество микросостояний.
Под микросостоянием системы понимается скорость и траектория каждой микрочастицы, составляющей систему, а также взаимное положение микрочастиц, число их столкновений и т.д.
Энтропия по Больцману: S = K · lnW,
где
W - вероятность состояния данной системы,
K - постоянная Больцмана.
Энтропия - мера неупорядоченности системы.
Определяется и рассчитывается абсолютная энтропия, приведённая к нормальным условиям.
Положительной энтропией обладают все реальные системы.
C (алмаз) - S 0(c) = +2,38 Дж/моль к.
Отсюда вытекает третье начало термодинамики:
Нулевой энтропией обладают идеальные кристаллы при абсолютном нуле.
В реальных условиях в изолированной системе величина связанной, или недоступной, энергии возрастает, то - есть самопроизвольно энтропия может только возрастать
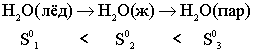 .
.
Данный процесс происходит с увеличением энтропии: ΔS0 > 0, обратный процесс ΔS0< 0.
Для самопроизвольных процессов в изолированной системе
ΔS 0298 > 0 - необратимый процесс,
ΔS 0298 = 0 - обратимый процесс.
Поскольку энтропия - функция системы, т.е. зависит от начального и конечного состояний системы, то изменение энтропии химического процесса зависит от вида и состояния исходных веществ и продуктов реакции.
aA + bB = cC +dD;
ΔS 0х.р. = (cS 0C + dS 0D) - (aS 0A + bS 0B) Дж/к.
Для изолированных систем изменение энтропии позволяет предсказать, будет ли процесс необратимым или обратимым.
Если изменение энтальпии равно нулю, то процесс обратимый.
Эти критерии не могут быть использованы для закрытых систем.
Для закрытых систем вводится новая термодинамическая функция - энергия Гиббса (изобарно - изотермический потенциал).
Рассмотрим закрытую систему, в которой процесс протекает при постоянной температуре.
Согласно второму началу термодинамики разрешены следующие превращения:
· для обратимого процесса: ΔS= Q/T; Q p =ΔS 0 T; Q p - ΔS 0 T= 0; ΔH 0 - ΔS 0 T= 0;
· для необратимого процесса: ΔS> Q/T; ΔS 0 T> Q; Qp < ΔS 0 T; Qp- ΔS 0 T<0; ΔH 0 -ΔS 0 T<0.
Разница между энтальпией и энтропией, помноженной на температуру, и есть энергия Гиббса
ΔH0 -ΔS0T = ΔG0.
Измеряется и рассчитывается только изменение энергии Гиббса:
ΔG 0298 кДж/моль.
Для простых веществ изменения энергии Гиббса равны нулю. Изменение энергии Гиббса, также как и энтропии, говорит о направлении протекания процесса.
Самопроизвольный необратимый процесс возможен только в том случае, если изменение энергии Гиббса меньше нуля
ΔG < 0.
| Знак изменения функции | Возможность протекания реакции | Пример реакции | ||
| ΔH0 | ΔS0 | ΔG | ||
| + | - | + | Невозможно ни при каких условиях | N2+2O2=2NO2 |
| - | + | - | Возможно при любых условиях | C2H2+7.5O2=6CO2+3H2O |
| - | - | + - | Возможно при низких температурах | 3H2+N2=2NH3 |
| + | + | + - | Возможно при высоких температурах | N2O4=2NO2 |
Поскольку ΔG - функция системы, то эта функция также зависит от начального и конечного состояний химической реакции, то - есть от исходных веществ и продуктов реакции.
|
|
|
Дата добавления: 2014-01-11; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!