
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Са2+-АТФ-аза
|
|
|
|
В цитозоле "покоящихся" клеток концентрация Са2+ составляет ~10-7 моль/л, тогда как вне клетки она равна ~2 10-3 моль/л. Поддерживает такую разницу в концентрации система
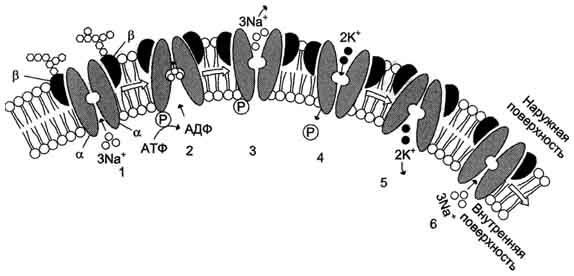
Рис. 5-19. Строение и функционирование Nа+,К+-АТФ-азы плазматической мембраны. 1 - три иона натрия связываются специфическим центром транслоказы; 2 - изменение конформации транслоказы, вызванное присоединением 3Na+, приводит к активации каталитической субъединицы и увеличению сродства активного центра к субстрату (АТФ). Протекает реакция аутофосфорилирования по карбоксильной группе аспарагиновой кислоты; 3 - аутофосфорИлирование изменяет заряд и конформа-цию транслоказы, она закрывается с внутренней стороны мембраны и открывается с наружной, уменьшается сродство к ионам натрия и они диссоциируют от переносчика; 4 - Na+, К+-АТФ-аза открытая с наружной стороны мембраны имеет специфический центр связывания для 2К+; Присоединение двух ионов калия к фосфорилированной транслоказе вызывает изменение конформации и появление аутофосфатазной активности. Протекает реакция аутодефосфорилирования; 5 - дефосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с наружной стороны мембраны и открывается с внутренней, уменьшается сродство к ионам калия и они диссоциируют от Na+, К+-АТФ-азы; 6 - АТФ-аза возвращается в первоначальное состояние.
активного транспорта ионов кальция; ее основные компоненты - кальциевые насосы - Са2+-АТФ-азы и Na+,Ca2+-обменники.
Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Работа Са2+-АТФ-азы цитоплазматической мембраны по стадиям представлена на рис. 5-20.
Нарушение активности Са2+-АТФ-азы при патологии. Одна из причин нарушения работы Са2+-АТФ-азы - активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-гpyппы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению кон-формации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилированию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается концентрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий
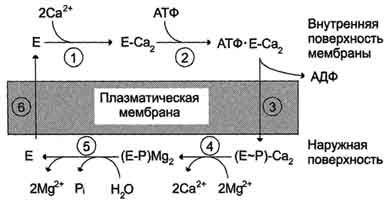
Рис. 5-20. Последовательность событий в процессе работы Са2+-АТФ-азы. 1 - связывание двух ионов кальция участком АТФ-азы, обращённой в цитозоль; 2 - изменение заряда и конформации фермента (АТФ-азы), вызванное присоединением двух ионов Са2+, приводит к повышению сродства к АТФ и активации аутофосфорилирования; 3 - аутофосфорилирование сопровождается информационными изменениями, АТФ-аза закрывается с внутренней стороны мембраны и открывается с наружной; 4 - происходит снижение сродства центров связывания к ионам кальция и они отделяются от АТФ-азы; 5 - аутодефосфорилирование активируется ионами магния, в результате Са2+-АТФ-аза теряет фосфорный остаток и два иона Мg2+; 6 - АТФ-аза возвращается в исходное состояние.
1.2.2.Структура и механизм функционирования Са+2-АТФ-азы мембран эндоплазматического ретикулума
Клеточная подвижность
Вопреки бытующему мнению, двигательной активностью обладают все без исключения клетки организма. Хотя двигательные реакции многих из них не столь очевидны, как мышечное сокращение, они не менее важны для поддержания гомеостаза. К примеру, иммунитет невозможен без амебоидного движения лейкоцитов и поглощения ими бактерий и обломков клеток; рост организма происходит в результате деления любых клеток, начиная со стволовой. Ни секреция гормонов и ростовых факторов, ни синаптическая передача нервного импульса, ни свертывание крови тромбоцитами, ни поглощение пищевых частиц кишечным эпителием, как и многие другие протекающие в организме процессы, не могут обходиться без двигательного компонента. Даже внутри клетки ситуация далека от статичной: многие органеллы постоянно перемещаются, и это активный процесс, требующий участия моторных белков и энергетических затрат.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1184; Нарушение авторских прав?; Мы поможем в написании вашей работы!