
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение уравнения Шредингера для водородоподобного атома
|
|
|
|
Рассмотрим простейший атом, состоящий из электрона зарядом e, двигающегося в кулоновском поле ядра с зарядом Ze, где Z – порядковый номер элемента в Периодической системе Дмитрия Ивановича Менделеева. Такую систему называют водородоподобной. При Z =1 это атом водорода, при Z =2 – однократно ионизированный атом гелия – He+, при Z =2 – двукратно ионизированный атом лития – Li2+ и так далее.
Хотя из всех атомов Периодической системы только водород и его изотопы относятся к одноэлектронным атомам, квантово-механическое рассмотрение систем этого типа имеет фундаментальное значение. Это объясняется тем, что для атомов и ионов с одним электроном может быть точно решено уравнение Шредингера, а полученные решения служат основой для изучения всех более сложных задач о многоэлектронных атомах и даже молекулах.
Потенциальная энергия U (r) взаимодействия электрона с ядром в рассматриваемой системе равна
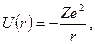
| (8.1) |
где r – расстояние между электроном и ядром, которое в первом приближении будем считать точечным (здесь и далее). Тогда уравнение Шредингера (ХХХ) в этом случае принимает вид
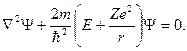
| (8.2) |
В представленном уравнении m должно быть приведённой массой ядра и электрона, но, учитывая факт, что электрон движется гораздо быстрее, можем говорить лишь о том, что m это его масса, не рассматривая массу ядра. Такое допущение в значительной степени упрощает поиск решения уравнения, а погрешность составляет порядка 0,05%.
Поскольку кулоновское поле ядра является центрально-симметричным, то есть зависит только от r, то решение уравнения (8.2) наиболее целесообразно проводить в сферической системе координат (связь декартовых координат x, y, z со сферическими координатами r, θ, j представлена на рисунке 1). Для этого воспользуемся следующими правилами перевода между декартовой и сферической системами координат:

|
Здесь dv – элемент объёма, координаты сферической системы имеют следующие интервалы: 0≤ r ≤∞, 0≤ θ ≤ π, 0≤ j ≤2 π.
Переход к сферическим координатам создаёт возможность разделения переменных в уравнении Шредингера, чего нельзя сделать при записи этого уравнения в декартовых координатах. В итоге оператор Лапласа принимает вид

| (8.3) |
Заменяя в уравнении (8.2) оператор Лапласа полученным оператором (8.3), приходим к выводу, что полная волновая функция, являющаяся решением уравнения Шредингера, может быть разделена на три составляющих – три функции каждой сферической координаты:
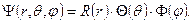
| (8.4) |
Мы не будем рассматривать полный ход решения, ограничимся лишь наиболее значимыми для нас моментами. Во-первых, первая составляющая – R (r) – является радиальной частью волновой функции и определяет расстояние электрона от ядра (в классической теории атома аналогом является радиус орбитали электрона), произведение двух других составляющих – Q(θ) и F(j) – представляет угловую часть волновой функции (в классическом представлении атома аналогом может служить форма и направление орбитали электрона). Во-вторых, полная волновая функции зависит от трёх целочисленных параметром: n, l и m, которые называются, соответственно, главное, орбитальное и магнитное квантовое число. При этом радиальная часть волновой функции зависит от n и l, а угловая – от l и m. Главное квантовое число n принимает значения 1, 2, 3 и так далее, орбитальное квантовое число принимает значение от 0 до n –1 при заданном значении n, а магнитное квантовое число принимает значения от – l до l при заданном значении l. Например, если n =2, то l принимает значения 0 и 1. Если l =0, то m также равно 0. Если l =1, то m принимает значения –1, 0 и 1.
Содержание
Элементы геометрической оптики. 1
Явление интерференции. 8
Тепловое излучение. 12
Корпускулярная природа света. 22
Элементы квантовой механики. 31
Квантовая механика атомов и молекул. 40
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2172; Нарушение авторских прав?; Мы поможем в написании вашей работы!