
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И давлением адсорбата
|
|
|
|
Связь Гибсовской адсорбции с активностью, концентрацией
Адсорбционное уравнение Гиббса
 (4.10)
(4.10)
является термодинамически строгим соотношением и справедливо для многокомпонентных систем. На практике очень часто нужно знать зависимость изменения 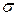 от адсорбции одного компонента при постоянстве
от адсорбции одного компонента при постоянстве 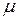 других веществ.
других веществ.
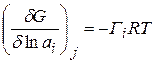 , отсюда
, отсюда
 (4.12)
(4.12)
Активность компонента связана с концентрацией через коэффициенты активности:
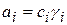
В разбавленных растворах 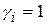 и
и  . Для растворенного вещества можно записать широко используемое адсорбционное уравнение Гиббса:
. Для растворенного вещества можно записать широко используемое адсорбционное уравнение Гиббса:
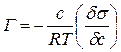 (4.13)
(4.13)
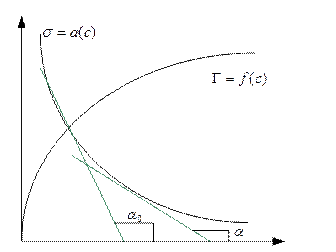
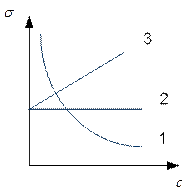
Рис. 4.2. Зависимость Г и 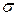 от концентрации растворенного вещества
от концентрации растворенного вещества
 - изотерма адсорбции
- изотерма адсорбции
Если адсорбция происходит из газовой среды, то удобнее выразить Г через давление. Из уравнения Менделеева-Клапейрона ( или
или 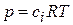 ). Отсюда:
). Отсюда:

 (4.14)
(4.14)
В разбавленных растворах гиббсовская адсорбция растворителя очень мала и изменение  очень мало при адсорбции растворенного вещества. Изменение поверхностного натяжения, связанное с изменением
очень мало при адсорбции растворенного вещества. Изменение поверхностного натяжения, связанное с изменением  растворителя (1) и растворенного вещества (2).
растворителя (1) и растворенного вещества (2).
 (4.15)
(4.15)
Значение  , тогда:
, тогда:
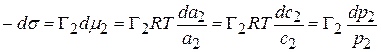 (4.16)
(4.16)
 Зная зависимость
Зная зависимость  можно рассчитать изотерму адсорбции компонента. Проведя касательные в нескольких точках кривой находят значение
можно рассчитать изотерму адсорбции компонента. Проведя касательные в нескольких точках кривой находят значение  и рассчитывают величину адсорбции. Затем строят график изотермы адсорбции.
и рассчитывают величину адсорбции. Затем строят график изотермы адсорбции.

4.4. Поверхностная активность. Поверхностно-активные (ПАВ)
и поверхностно-инактивные вещества (ПИАВ)
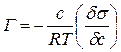
В уравнении гиббсовской адсорбции величина  служит характеристикой вещество при адсорбции. При
служит характеристикой вещество при адсорбции. При  Ребиндер назвал её поверхностной активностью:
Ребиндер назвал её поверхностной активностью:
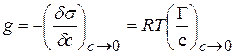 (4.17)
(4.17)
Если  , то исключается влияние концентрации компонента на производную.
, то исключается влияние концентрации компонента на производную.
При положительной адсорбции величина  имеет отрицательный знак, т.е. с увеличением концентрации
имеет отрицательный знак, т.е. с увеличением концентрации  уменьшается.
уменьшается.
Единицы измерения поверхностной активности в СИ  .
.
Физический смысл  : она представляет силу, удерживающую вещество на поверхности и рассчитанную на единицу гиббсовской адсорбции.
: она представляет силу, удерживающую вещество на поверхности и рассчитанную на единицу гиббсовской адсорбции.
Чем больше уменьшается  с увеличением концентрации вещества, тем больше
с увеличением концентрации вещества, тем больше  этого вещества.
этого вещества.  можно рассчитать графически как отрицательный тангенс угла наклона касательной, проведенной к кривой зависимости
можно рассчитать графически как отрицательный тангенс угла наклона касательной, проведенной к кривой зависимости  в точке ее пересечения с осью абсцисс (
в точке ее пересечения с осью абсцисс (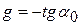 ) – см. предыдущий рисунок.
) – см. предыдущий рисунок.
Поверхностная активность, как и гибсовская адсорбция, может быть положительной и отрицательной. Абсолютное значение и знак  зависят от природы адсорбируемого вещества и растворителя.
зависят от природы адсорбируемого вещества и растворителя.
1) Если 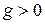 ,
, 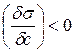 и Г>0 – понижение
и Г>0 – понижение 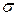 с увеличением концентрации – такие вещества называются поверхностно-активными.
с увеличением концентрации – такие вещества называются поверхностно-активными.
2) Вещества, повышающие 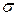 на границе раздела фаз с увеличением концентрации называют поверхностно-инактивными. Для них
на границе раздела фаз с увеличением концентрации называют поверхностно-инактивными. Для них 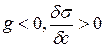 и Г<0, исходя из этого видно, что концентрация вещества в объеме больше чем в поверхностном слое.
и Г<0, исходя из этого видно, что концентрация вещества в объеме больше чем в поверхностном слое.
3) Вещества, для которых с увеличением концентрации поверхностное натяжение не меняется и 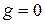 называются поверхностно-индифферентными, для них
называются поверхностно-индифферентными, для них 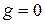 ,
,  =0 и Г=0.
=0 и Г=0.
ПАВ обладают очень высокой поверхностной активностью по отношению к воде, что объясняется, главным образом, их строением. Молекулы ПАВ дефильны (гидрофильная и олеофильная группы), они имеют неполярную (углеводородную) часть и полярную, представленную функциональными группами 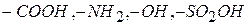 и др.
и др.
Углеводородные радикалы выталкиваются на поверхность, и их адсорбция Г > 0. К ним относятся соли жирных кислот (мыла), амины, спирты, сульфокислоты. Поверхностная активность зависит от длины углеводородного радикала. Увеличение длины радикала на 1 группу  приводит к возрастанию поверхностной активности примерно в 3,2 раза (правило Дюкло-Траубе).
приводит к возрастанию поверхностной активности примерно в 3,2 раза (правило Дюкло-Траубе).
Примером ПИАВ по отношению к воде являются неорганические соли, которые сильно гидратируются. Их взаимодействие с водой сильнее, чем между молекулами воды и Г <0, образуются сольватные оболочки.
4.5. Адсорбционно-десорбционное равновесие на границе «твердое тело-газ»
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 652; Нарушение авторских прав?; Мы поможем в написании вашей работы!