
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы реальных газов
|
|
|
|
Для описания состояний реальных газов используют более сложные уравнения, в которых учитываются межмолекулярные взаимодействия. Для этого в уравнения вводятся эмпирические параметры, индивидуальные для каждого газа. Известно более 100 таких уравнений, которые отличаются числом переменных, степенью точности и областью применения. В таблице 1.2. приведены некоторые уравнения состояния реальных газов.
Таблица 1.2. Уравнения состояния реальных газов (для одного моль газа)
| Уравнение | Обычная форма | Приведенная форма | P c | T c | V c | Z c |
| Ван-дер-Ваальса (1873) | 
| 
| 
| 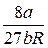
| 3 b | 
|
| Дитеричи (1898) | 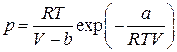
| 
| 
| 
| 2 b | 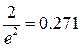
|
| Бертло (1900) | 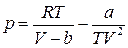
| 
| 
| 
| 3 b | 
|
| Битти–Бриджмена (1927) | 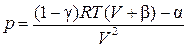 , где , где  , , 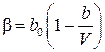 , , 
| |||||
| Вириальное (1901) (Камерлинг –Оннес) | 
|
Наиболее известно уравнение Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса:

 ,
,
где V m –молярный объем

Изменения термодинамических параметров для реальных газов показаны на рис. 1.18.

Рис. 1.18. Иллюстрация изменения параметров термодинамического процесса для реальных газов.
Вопросы для самоконтроля
1. Покажите, что при больших объемах уравнения Ван-дер-Ваальса и Детеричи переходят в уравнение идеального газа.
2. В некоторой системе теплота изменяется в зависимости от температуры и объема по уравнению:  , где C, R = const. В данной системе теплота является функцией состояния или процесса?
, где C, R = const. В данной системе теплота является функцией состояния или процесса?
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 765; Нарушение авторских прав?; Мы поможем в написании вашей работы!