
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественный анализ. Цель количественного анализа – определение массы или концентрации вещества в пробе раствора. План: 1
|
|
|
|
Цель количественного анализа – определение массы или концентрации вещества в пробе раствора.
| План: 1. Классификация методов количественного анализа. 2. Титриметрический метод анализа. 3. Требования к химической реакции в титриметрическом методе анализа. 4. Способы отбора пробы при титровании. 5. Способы (методы) выполнения титрования. 6. Растворы. Приготовление. 7. Фиксирование точки эквивалентности, кривые титрования. | Количественный анализ вещества – экспериментальное определение (измерение) концентрации (количества) химических элементов (соединений) или их форм в анализируемом веществе, выраженное в виде границ доверительного интервала или числа с указанием стандартного отклонения (Журнал аналитической химии) |
Количественный анализ с применением классических химических методов выполняются либо гравиметрически, либо титриметрически.
Гравиметрический (весовой) анализ основан на установлении массы вещества или какого-либо его производного в анализируемой пробе (растворе) с использованием аналитических весов.
Этот анализ может быть основан 1) на реакциях осаждения определенного иона или 2) в его основе находятся процессы дистилляции (перегонки). В любом случае окончательный результат получают посредством установления массы осадка или дистиллята.
Метод гравиметрии точен, но длителен.
Титриметрический метод анализа основан на регулированном прибавлении раствора одного вещества к раствору другого вещества.
Метод титриметрии экспрессен (быстро получают результаты), но менее точен.
Раствор, содержание вещества в котором точно известно называется стандартным (титрованным), если его концентрацию устанавливали в ходе титрования.
Стандартизованным раствор (рабочий раствор) помещают в бюретку, им титруют, поэтому он называется титрантом.
Титрант к титруемому раствору добавляют порциями. Этот процесс называют титрование. При этом количество титруемого вещества должно быть равно количеству вещества титранта.
n1 = n2
Момент окончания реакции в титровании называют точкой стехиометричности (эквивалентности) – может быть зафиксировано с индикатором, без индикатора или инструментально.
По типу химической реакции методы титриметрии различают:
1. кислотно-основные (протолиметрия) ОН– + Н+ Н2О
Н2О
2. окислительно-восстановительные (редоксиметрия) Ox + e ®Red
3. комплексонометрические (комплексонометрия) А + В ®[AB]
4. осадительное титрование А + В ®АВ¯
.ТРЕБОВАНИЯ к реакциям, применяемым в титриметрии:
– Реакция должна быть необратимой, т.е. проходить практически до конца, Кр>> 1.
– Проходить в строго эквивалентных соотношениях.
– Точка стехиометричности должна легко фиксироваться.
– Отсутствие побочных реакций.
– Вспомогательные вещества (индикаторы), буферные смеси и т.д. не должны мешать основной реакции.
4. По спосбу отбора пробы для титрования различают
· Метод пипетирования – проба в жидком агрегатном состоянии отбирают пипеткой, титруют, расчет по
vx·cx = vт-та·ст-та
· Метод точной навески – пробу в любом агрегатном состоянии взвешивают на аналитических весах, растворяют, если это необходимо в подходящем растворителе и титруют, расчет ведут по формуле:
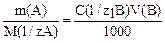 .
.
5 Способы титрования:
– прямой
– косвенный
· по избытку (по остатку)
· метод замещения
В ходе прямого титрования титрант непосредственно реагирует с веществом титруемого раствора.
В ходе косвенных методов титрант не взаимодействует непосредственно с титруемым веществом, т.к. невозможно либо зафиксировать точку стехиометричности, либо реакция протекает нестехиометрично, либо медленно, т.е. не выполняются требования к химическим реакциям.
По избытку (остаток) А + Визб. ® АВ + Визб.остаток
В + Т ® ВТ
Заместительное А + В ® С
С + Т ® СТ
na = nc = nт
6. Стандартные растворы – концентрация известна
1) По навеске стандартного вещества – в мерной колбе (первичный стандарт)
2) Из стандартного раствора с большей концентрацией (пипетка, мерная колба)
3) Титрование нестандартного раствора (стандартизовано)
4) Из фиксанала (первичный стандарт).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!