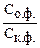КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Требования к рН-индикаторам. В основе метода находится реакция нейтрализации
|
|
|
|
Рабочие растворы
2.
В основе метода находится реакция нейтрализации
ПРОТОЛИТОМЕТРИЯ
(рН-метрия, кислотно-основное титрование)
| План: 1. Сущность метода, классификация метода. 2. Стандартные вещества, рабочие растворы, определяемые соединения. 3. Кислотно-основные индикаторы (рН-индикаторы). Из истории рН-индикаторов. Теория индикаторов 4. Кривые титрования метода рН-метрии 5. Практическое применение метода рН-метрии. | Изучать аналитическую химию необходимо при подготовке самых разных специалистов и, разумеется, не только химиков. Совершенно очевидно, что и фармацевт, и агрохимик, и эколог, и военный химик, и геохимик – все... должны понимать основы химического анализа, иметь соответствующие практические навыки. (академик Ю.А. Золотов) |
1.
Н3О+ + ОН-® 2Н2О
Н+ + ОН- -® Н2О
Если рассматривать как протолитометрию, то происходит реакция передачи протона от титранта к титруемому веществу или наоборот.
Различают методы алкалиметрии – титрование раствором основания и ацидометрию –титрование кислотой.
НСl Н2SO4
NaOH KOH
концентрации 0,05 -1,0 моль/дм3
Растворы кислот более устойчивы, щелочи поглощают СО2 и взаимодействуют со стеклом – хранить в парафинированной или полиэтиленовой посуде и периодически уточнять титр раствора.
Стандартные растворы – из стандартных веществ в алкалиметрии Н2С2О4∙2Н2О, бензойная кислота, гидрофталат калия и т.д.
в ацидиметрии – Nа2СО3 (сода), Nа2В4О7·10Н2О (бура).
Стандартизировать растворы можно по соответствующим фиксанальным растворам.
3
indicare (лат.) – показывать, обнаруживать
Первоначально в качестве индикаторов применялись природные красители – вытяжки из лепестков и других частей растений (см. случай Р.Бойлем) или без индикатора – при титровании карбонатов.
Наиболее употребительны органические красители, изменяющие окраску в зависимости от рН раствора, поэтому они называются рН-индикаторами.
- при близких значениях рН окраска должна быть значительно различима;
- окраска должна изменяться мгновенно и обратимо;
- должна быть интенсивной;
- количество реагента для изменения окраски должно быть минимальным.
Классификация индикаторов
по цвету:
- одноцветные (ф-ф);
- двуцветные (м-о);
- полихромные (универсальный индикатор).
по силе:
условно различают индикаторы: сильные (рК<7) и слабые (рК>7).
Теория индикаторов
Ионная теория индикаторов (Оствальда).
Индикатор – слабая кислота или основание
 |
НInd  Н+ + Ind-
Н+ + Ind-
НInd – кислотная форма, Ind- - кислотная основная формы имеют различную окраску
Кр = 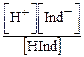 ; [H+] =
; [H+] = 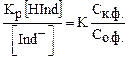
|
Основное уравнение ионной теории индикаторов показывает как рН влияет на соотношение концентраций основной и кислотной форм индикатора.
Если Сосн..> Скисл. – окраска будет соответствовать основной форме;
если Скисл > Сосн - окраска кислотной формы;
если Скисл = Сосн - смесь окрасок.
рН = рК = рТ - показатель титрования.
Глаз человека чувствует изменение окраски, если 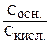 10:1 или 1:10, т.е. рН = рКинд ± 1
10:1 или 1:10, т.е. рН = рКинд ± 1
DрН от рК +1 до рК – 1 – интервал перехода окраски индикатора - интервал рН в которм происходит изменение окраски.
На самом деле DрН несколько меньше.
Недостатки теории Оствальда – не объясняет почему окраска меняется немгновенно.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 494; Нарушение авторских прав?; Мы поможем в написании вашей работы!