
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Индикаторные ошибки. Ионно-хромофорная теория
|
|
|
|
Ионно-хромофорная теория
Хромоформная теория индикаторов
Объясняет связь изменения окраски индикатора с изменением структуры вещества (происходит таутомеризация):
1 и2 – таутомеры, соответственно бензольная структура и хиноидная структура;
Чтобы вещество было окрашено в молекуле должны быть хромофоры – группы атомов, сообщающие окраску.
Чтобы окраска была более интенсивной – должны присутствовать ауксохромы – группы, усиливающие окраску –ОН, -NН2, -СООН.
Таутомеры могут быть либо кислотами, либо основаниями
- -на смещение равновесия требуется избыток титранта;
- если раствор индикатора готовят в органическом растворителе, то происходит изменение степени диссоциации;
- субъективные ошибки – восприятие глаза человека освещенности;
Ошибки могут быть за счет перетитровывания – т.е. индикатор меняет окраску после добавления избытка титранта.
Ошибки за счет недотитровывания – индикатор меняет окраску до достижения точки эквивалентности.
Одним из примеров выбора индикатора – метод кривых титрования.
Кривые кислотно-основного титрования
Титрование сильной кислоты сильным основанием и наоборот
| f, % | [H+] | [OH–] | 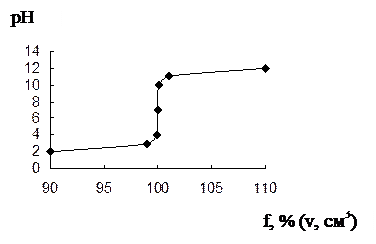 рН рН
|
| 10–1 | |||
| 10–2 | |||
| 10–3 | |||
| 99,9 | 10–4 | ||
| 10–7 | 10–7 | ||
| 100,1 | 10–4 | ||
| 10–3 | |||
| 10–2 |
скачок от 4 до 10, т.э. совпадает с т.н., линия эквивалентности. совпадает с линией нейтральности, можно применять ф-ф и м-о.
Изменение концентрации в 10 раз приводит к уменьшению и возрастанию скачка соответственно на 2 единицы.
| f, % | [H+] | [OH–] | рН |
| 10–12 | 10–2 | ||
| 10–11 | 10–3 | ||
| 10–10 | 10–4 | ||
| 99,9 | 10–9 | 10–-5 | |
| 10–7 | 10–7 | ||
| 100,1 | 10–-5 | ||
| 10–4 | |||
| 10–3 |
концентрации титранта и титруемого раствора
0,001 М скачок от рН 8 до рН 6, ТЭ – рН 7
0,0001 М скачок рН до рН 7, ТЭ – рН = 7 (может быть?)
Титрование слабой кислоты сильным основанием
| f | Что в колбе | Формула для расчета | рН |
| 0,1 м АсН | рН = 1/2рКа- 1/2lgСа | 2,9 | |
| 50 АсН 50 АсNa | 4,8 | ||
| 10 АсН 90 АсNa | 5,8 | ||
| 1 АсН 99 АсNa | рН = рКа - lg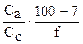
| 6,8 | |
| 99,9 | 0.1 АсН 99.9 АсNa | 7,8 | |
| АсNa избыток NаОН | рН =7+1/2рКа + ½ lgСс | 8,9 | |
| 100,1 | 0,1 | ||
рН = 14 + lgС0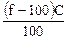
| |||
Скачок уменьшается с возрастанием рКа
Титрование слабого основания сильной кислотой
| f | Что в колбе | Формула для расчета | рН |
| 0,1м NН4ОН | 14–1/2рКв + 1/2lgСв | 12,1 | |
| 50% NН4ОН 50% NН4СI | 9,2 | ||
| 10% NН4ОН 90% NН4СI | 8,2 | ||
| 1% NН4ОН 99% NН4СI | рН=14–рКв + lg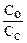
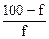
| 7,2 | |
| 99,9 | 0,1% NН4ОН 99,9% NН4СI | 6,2 | |
| 100% NН4СI | 5,1 | ||
| 100,1 | 0,1% HCI | ||
| 1% HCI | рН = –lgСк |
Титрование слабой кислоты слабым основанием
нет скачка – при визуальном фиксировании т.с. титрование невозможно
Титрование многоосновных кислот
Н3РО4 К1i=10–2
К2i=10–7
К3i=10–13 3 скачка
Титрование смесей – оттитровывается сначала сильная кислота, затем слабая, аналогично – основания.
Можно оттитровать, если 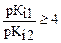
Nа2СО3 + NаОН 1) + фенолфталеин – весь NаОН и 1/2 Nа2СО3 до СО2
2) + метиловый оранжевый
остаток Nа2СО3 до СО2
ВЫВОДЫ
Кривые титрования строятся для выбора индикатора.
Кривая титрования имеет скачкообразный вид, скачок наблюдается вблизи точки эквивалентности, он зависит от
1) величины Кi (рК) титруемого вещества и титранта, чем больше рК, тем больше скачок
2) от концентрации растворов титруемого вещества и титранта, чем больше С, тем больше скачок
При титровании многоосновных кислот на кривых титрования несколько скачков, если Кi по ступеням различаются на 4 порядка.
При титровании в среде органических растворителей может изменяться сила кислот и оснований, что приводит к изменению скачка кривой титрования.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 656; Нарушение авторских прав?; Мы поможем в написании вашей работы!