
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Связь между числами переноса ионов
|
|
|
|
Числа переноса ионов
1. Определение:  .
.
2. Связь 
а)  ,
, 
б) 
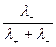
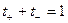 ,
, 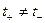 .
.
Применение измерений электропроводности для определения термодинамических свойств растворов электролитов
1. Расчет 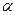 и
и 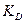
а)  ,
, 

б) графический метод, 

2. Термодинамика электролитической диссоциации
а) 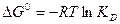
б)  1)
1) 
2) 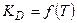 проходит через max
проходит через max 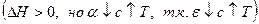
в) расчет 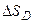 ,
, 
3. Определение  раствора
раствора
 ,
,  ,
, 
4. Определение растворимости малорастворимых соединений
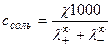 , где
, где 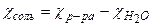

5. Кондуктометрическое титрование 
а) cущность метода – определение точки эквивалентности по зависимости 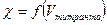
б) пример титрования кислоты щелочью: 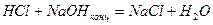
1) до точки эквивалентности: 
2) после точки эквивалентности: 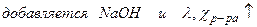
3) практически линейная зависимость  , т.к.
, т.к. 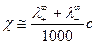
4) достоинства и ограничения метода
а) окрашенные соединения, чувствительность 
б) ограничение – различие в величинах 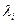
Дальнейшее развитие теории Дебая-Хюккеля.
1. Второе приближение теории – учет размеров ионов (до  ).
).
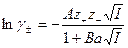 ,
, 

2. Третье приближение теории – учет  (до
(до 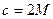 ).
).
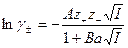
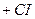 ,
, 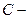 эмпирическая константа
эмпирическая константа
Электропроводность растворов сильных электролитов.
1. Снижение электропроводности с ростом концентрации  - следствие
- следствие
уменьшения подвижности ионов из-за наличия ионной атмосферы.
2. Электрофоретический эффект торможения  .
.
а) Движение в неподвижном и «подвижном» растворителе.
б) Увеличение силы внутреннего трения во встречном потоке растворителя.
б) Увеличение тормозящего эффекта с ростом концентрации.
3. Релаксационный (ассиметрический) эффект торможения  .
.
а) Разрушение-создание ионной атмосферы при движении ионов.
б) Нарушение симметрии ионной атмосферы – за ц. ионом возни-
кает «хвост» из ионов противоположного знака (схема).
в) Время релаксации: 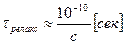 , где
, где 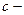 концентрация эл-та.
концентрация эл-та.
4. Суммарный эффект снижения электропроводности:
 .
.
Уравнение (теоретическое) Онзагера.
а) Для электролитов типа 1:1 на основании представлений о статистической природе ионной атмосферы 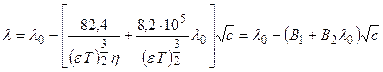
б) Теоретическая оценка вкладов электростатического и релакса-
ционного торможения в снижение электропроводности.
 |

Эффекты электропроводности в электрических полях
высокой напряженности и высокой частоты.
1. Эффект Вина (1927) – 200000-400000 В/см.
а) характер изменения зависимости  ,
,
б) 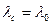 , т.к.
, т.к. 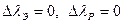 .
.
2. Эффект Дебая-Фалькенхагена.
а) предсказание эффекта полей высокой частоты,
б) частота поля  :
: 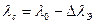 , т.к.
, т.к.  ,
,
в) 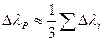
Аномальная электропроводность. Ассоциация ионов.
1. Характер зависимости электропроводности р-ров электролитов в
растворителях с малой диэлектрической проницаемостью.
2. Объяснение – образование ассоциатов:
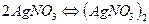
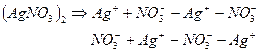
3. Причины ассоциации - превалирование сил эл.-ст. взаимодействия
над энергией теплового движения ионов (Семенченко, Бьеррум):
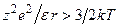
4. Отличие ионных пар от сольватированных молекул.
5. Константа диссоциации ионных пар (Семенченко).

Сольватация (гидратация) ионов
1. Сольватация (гидратация) – процесс образования доста- точно прочной конфигурации каждого иона с определенным числом дипольных молекул р-ля в результате эл.-ст. вз-вия

 ,
, 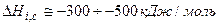
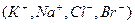
2. Первичная и вторичная сольватация
а) Число связанных с ионом молекул растворителя называется сольватным (гидратным) числом иона
б) первичная сольватация состоит в прочном связывании мо-лекул растворителя с ионом и молекулы р-ля участвуют в тепловом движении совместно с ионами как единое целое
в) вторичная сольватная оболочка – более слабая связь
г) значения чисел сольватации 
д) координационное число – предельное число ближайших к иону молекул растворителя
3. Противоречие между размерами (кристаллографическими радиусами) и подвижностями ионов – 1-ое указание на наличие в растворе не свободных, но гидратированных ионов
а) 
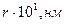



б)  ,
, 
4. Меньше размер – более высокая напряженность эл. поля на поверхности  сольватные оболочки большего размера
сольватные оболочки большего размера
Растворимость малорастворимых соединений.
1. Состояние малорастворимого электролита в растворе
1) растворимость – концентрация насыщенного раствора
2) малорастворимое соединение диссоциировано нацело
3) растворимость определяется концентрацией его ионов
2. Произведение растворимости, 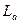
1)  ,
,
2) общий случай,
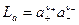



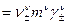
3) малая растворимость электролита, 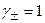

4. Формулы для расчета растворимости малорастворимых электролитов типа 1:1.

а) в отсутствие в растворе посторонних электролитов
 ,
, 
б) при наличии в системе индифферентного электролита:
 ,
,  , растворимость растет
, растворимость растет
в) в присутствии в системе постороннего электролита (концентрация  ) типа 1:1 с одноименным анионом
) типа 1:1 с одноименным анионом
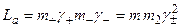 , где
, где 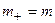 ,
, 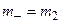

 , растворимость падает
, растворимость падает
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ЭДС ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
Возникновение скачков потенциала на границах раздела фаз
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!