
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые особенности неравновесного процесса
|
|
|
|
Энтропия и неравновесные процессы.
Процесс проходит естественным образом, термодинамически необратимо, если движущие силы системы или окружающей среды превышают силы, на преодоление которых они направлены. Применительно к процессу расширения газа это условие сводится к тому, чтобы температура теплоисточника была существенно выше, чем температура воды и соответственно газа. В этом случае движущей силой становится тепловой поток, обусловленный градиентом температур между тепловым источником и системой. В естественном процессе система не может находиться в состоянии внутреннего равновесия, когда температура имеет физический смысл для системы в целом. В реальном процессе она разная в различных частях системы. Из-за неоднородности теплового поля в воде и контактирующем с ней газе возникают макроскопические движения в виде завихрений, беспорядочных разнонаправленных динамических потоков. Жидкости и газа, включая идеальные, обладают внутренним трением и для создания завихрений и беспорядочных потоков необходима работа, которая создается тепловым потоком. В реальных условиях между стенками цилиндра и поршнем существует сила трения, на преодоление которой также затрачивается работа. Очевидно, что только по этим далеко не исчерпывающим причинам, в реальном процессе расширения газа от V1 до V2 необходимо затратить энергии в форме теплоты больше, чем в равновесном процессе. Из этого рассмотрения следует, что состояние теплоисточников, в общем смысле окружающей среды, в конце неравновесного процесса в принципе другое по сравнению с равновесным. Но количественно оценить различие в состояниях окружающей среды в равновесном и неравновесных процессах невозможно из-за неопределенности самого понятия окружающей среды.
Планком разработана концепция, которая позволяет в самом общем виде определить изменения в окружающей среде через изменения в самой системе, связанные с необратимыми явлениями внутри самой системы.
Перепишем (1) в следующем виде
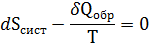
Планк обосновал, что 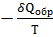 можно рассматривать как дифференциал энтропии окружающей среды
можно рассматривать как дифференциал энтропии окружающей среды
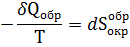
Следовательно
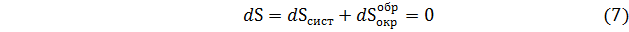
где S- суммарная энтропия системы и окружающей среды.
Из уравнения (7) имеем
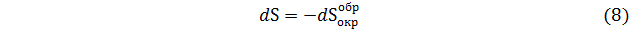
Для конечного превращения
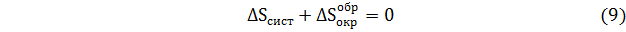
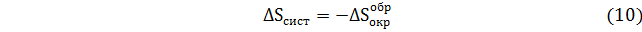
Из уравнений (7)-(10) следует, что изменения в окружающей среде в обратимом процессе, выраженные через изменения энтропии системы, по абсолютной величине такие же, как в самой системе. Таким образом, если система в циклическом процессе возвращается в исходное состояние, в свое первоначальное состояние должна возвращаться и окружающая среда. Вследствие этого изменение суммарной энтропии равно нулю.
Необратимость процесса связана с необратимыми явлениями в самой системе. В рассмотренном примере это создание хаотических завихрений в жидкости и газе и движение поршня с преодолением сил трения. Эти неравновесные явления в системе в принципе нельзя обратить. Другими словами невозможно провести процесс в обратном направлении с неравновесными явлениями в системе таким образом, чтобы система прошла через те же самые состояния, которые были в прямом направлении. Обратный процесс также необратим с присущими ему неравновесными явлениями.
Для неравновесного процесса
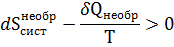
где 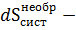 изменение энтропии системы в необратимом процессе.
изменение энтропии системы в необратимом процессе.
Но энтропия свойство системы, поэтому
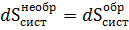
Изменение энтропии системы в необратимом процессе такое же как и в обратимом процессе. Поэтому в дальнейшем для энтропии системы будем опускать указания о необратимости процесса.
Таким образом
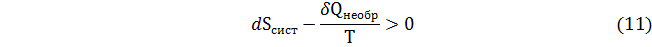
В соответствии с концепцией Планка
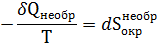
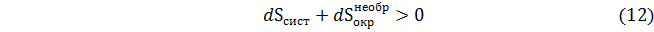
Для конечного приращения
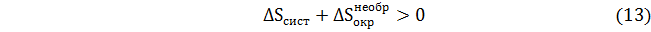
где 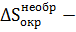 изменение энтропии окружающей среды в необратимом процессе.
изменение энтропии окружающей среды в необратимом процессе.
Эту величину можно представить в следующем виде
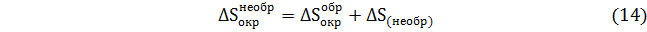
Имея в виду соотношение (13) можно написать
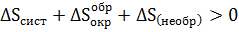
Но первые два слагаемые равны n0 абсолютной величины и противоположны по знаку. Тогда в окончательном виде имеем
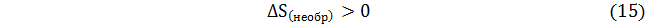
Очевидно, что данное соотношение отражает не что иное как увеличение энтропии внешней среды в необратимом процессе по сравнению с энтропией окружающей среды в процессе, протекающем термодинамически обратимо. Этот важный вывод Планк выразил такими словами: «нет другой общей меры необратимости процесса, кроме величины сопровождающего его увеличения энтропии».
Планк отмечал, что для выполнимости принципа возрастания общей энтропии необязательно, чтобы оба слагаемые в соотношениях (12)–(13) возрастали. Одно из них может иметь отрицательное значение, другое положительное, например, 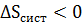 ;
; 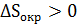 или наоборот
или наоборот 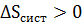 ;
; 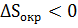 . Но их сумма в соответствии с принципом Планка всегда положительна, что отражается неравенством (15).
. Но их сумма в соответствии с принципом Планка всегда положительна, что отражается неравенством (15).
Рассмотрим два примера, иллюстрирующих принцип возрастания общей энтропии, выражаемое соотношением (15).
В общем случае причиной необратимых явлений в системе является неуравновешенность движущих сил процесса и внешних сил, на преодоление которых направлен процесс. Это несоответствие делает процесс реальным явлением, и оно не является причиной его необратимости. Это положение справедливо и для химических реакций в их обычном варианте как самопроизвольного процесса. В этом случае термодинамической системой является совокупность веществ, которые являются реагентами и продуктами.
Забегая вперед отметим, что в реакции А→В движущей силой в термодинамическом смысле является неравенство μ В – μ А < 0, где μ В, μ А – химические потенциалы веществ А и В в исходном состоянии, до начала реакции. Если разность отрицательная, возможно самопроизвольное неравновесное превращение А в В.
Химическую реакцию можно провести и термодинамически обратимо, если использовать гальванический элемент. В этом случае существует возможность уравновесить физико-химические силы реакции (∆ μ) внешней работой гальванического элемента, обладающей своей электродвижущей силой. Причем такое уравновешивание с точностью до бесконечно малых возможно на каждом этапе превращения А в В, что позволяет осуществить процесс квазистатически.
Предположим, что химическая реакция, проходящая обычным образом, экзотермическая и в процессе ее осуществления в окружающую среду выделяется теплота, равная ∆ Н0. Для химической реакции
Н2 (г) + 1/2О2 (г) → Н2О (ж) (16)
∆ Н0 = -187,0 кДж/моль
Для необратимых изотермических процессов, в частности для химических реакций есть возможность определить изменение энтропии окружающей среды по величине ∆ Н0
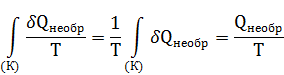
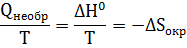
где, 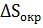 – изменение энтропии окружающей среды в реакции (16).
– изменение энтропии окружающей среды в реакции (16).
В соответствии с этим уравнением
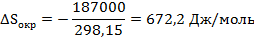
Для изменения суммарной энтропии имеем
∆Sобщ = -127,2 – 672,2 = 545 Дж/моль·К (17)
Существую методы, которые позволяют вычислять изменение энтропии в химических реакциях, протекающих необратимо. В частности для реакции (16) оно равно -127,2 Дж/моль·К.
Энтропия функция состояния и ее изменение в реакции, протекающей термодинамически обратимо (то есть в реакции, протекающей квазистатически в гальваническом элементе) будет таким же. При этом изменение энтропии окружающей среды составит 127,2 Дж/моль·К. Для разности между изменениями энтропии окружающей среды в необратимом и квазистатическом процессах имеем
672,2 – 127,2 = 545 Дж/моль·К
В соответствии с неравенством (15) изменение суммарной энтропии в необратимой реакции (16) отражает увеличение энтропии окружающей среды в необратимой реакции по сравнению с изменением окружающей среды в реакции, протекающей квазистатически.
Для реакции Hg2Cl2 (тв) + Ag (тв) → 2AgCl (тв) + 2Hg (ж) (18)
∆ Н0 = 11,30 кДж/моль; ∆ S0 = 63,26 Дж/моль·К
Для изменения общей энтропии получаем
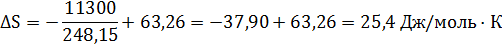
Для реакции, протекающей квазистатически, изменение окружающей среды равно -63,26 Дж/моль·К. Поэтому изменение общей энтропии, равное 25,4 Дж/моль·К, и в этом случае отражает увеличение энтропии окружающей среды в неравновесной реакции по сравнению с квазистатической:
-37,90 – (- 63,26) = 25,4 Дж/моль·К
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!