
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетический закон действующих масс
Скорость реакции
При исследовании кинетических закономерностей на базе экспериментальных данных находят соотношения между различными измеряемыми величинами: концентрациями реагентов и временем; скоростями реакции и концентрациями; скоростями реакций и различными параметрами состояния системы.
Реакционная система - это часть пространства, которая ограничена контрольной поверхностью и заключает внутри себя составляющие вещества – реагенты, интермедиаты и продукты, а также инертные компоненты.
Реакционная система может быть открытой или закрытой. Если на закрытую систему наложено дополнительное условие постоянства объема, то такая система называется статической.
Полагаем, что химическая реакция протекает при постоянной температуре в термически однородной системе.
Скорость простых химических реакций – это число элементарных актов, происходящих в единицу времени в единице реакционного пространства. Реакционное пространство – это или объем или поверхность.
В то же время прямых экспериментальных методов, позволяющих непосредственно измерять число элементарных актов, не существует. Поэтому чаще всего концентрации веществ и их изменение во времени оказываются единственным источником информации о реакционной системе и ее временной эволюции.
Для простых реакций, протекающих в закрытых системах с постоянным объемом существует связь между скоростью реакции в целом и скоростью накопления продукта или скоростью расходования реагента.
Для сложных реакций в общем случае говорить о скорости всей реакции нельзя. Там возникают промежуточные соединения, они расходуются, там очень сложные процессы и там говорят или о скорости расходования исходных веществ или о скорости накопления продуктов, но не о скорости всей реакции.
В химической кинетике постулативно вводится следующее утверждение: скорость простой реакции пропорциональна произведению концентраций каждого из веществ, реализующих эту реакцию, в степенях, равных их стехиометрическим коэффициентам. Это кинетический закон действующих масс или основной постулат химической кинетики.
В середине 19 века основной постулат применяли ко всем реакциям, так как представления о простых и сложных реакциях еще не использовались. Теперь область применимости кинетического закона действующих масс четко ограничена только элементарными реакциями. Тогда коэффициенты соответствуют молекулярности реакции по реагентам, и могут быть лишь положительными, целыми числами. Коэффициент пропорциональности в этом уравнении – это важнейший кинетический параметр – константа скорости реакции. Её размерность зависит от способа выражения концентрации и от общей молекулярности реакции.
Для любой элементарной реакции константа скорости является ее фундаментальной характеристикой, которая зависит только от температуры. Это означает, что при данной температуре, константа скорости какой-либо элементарной реакции будет иметь одно и то же численное значение, не зависящее от того, протекают ли в реакционной системе какие-либо другие реакции.
Это является сутью принципа независимости, который лежит в основе кинетического анализа сложных процессов.
В химической кинетике любые уравнения связывающие скорость реакции с концентрациями компонентов реакционной смеси, называют кинетическими уравнениями. Это относится как к простым, так и к сложным реакциям. Для простых реакций кинетическое уравнение всегда имеет степенную форму, в случае сложных реакций оно может быть любым: дробно-линейным, полиномиальным, но не обязательно степенным.
Часто все-таки и для сложных реакций используют степенную форму кинетического уравнения.
Например, для реакции
a 1 A 1 + a 2 A 2 = a 3 A 3 + a 4 A 4.
скорость, определенную по убыли концентрации реагента A1 (или A2) или по росту концентрации продукта A3 обычно представляют в виде
wэксп = k эксп 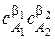 .
.
Показатели степени 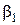 и
и 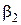 были названы В.Оствальдом порядками реакции по веществам A1 и A2. Коэффициент пропорциональности в этом уравнении – это наблюдаемая, (кажущаяся, эффективная, экспериментальная) константа скорости. Она как и порядок реакции является чисто эмпирическим параметром, в отличие от констант скорости простых реакций, которые принято называть истинными. Наблюдаемая в сложных реакциях константа скорости может зависеть не только от температуры, но и от концентраций как реагентов, так и продуктов реакции а также от присутствия посторонних веществ.
были названы В.Оствальдом порядками реакции по веществам A1 и A2. Коэффициент пропорциональности в этом уравнении – это наблюдаемая, (кажущаяся, эффективная, экспериментальная) константа скорости. Она как и порядок реакции является чисто эмпирическим параметром, в отличие от констант скорости простых реакций, которые принято называть истинными. Наблюдаемая в сложных реакциях константа скорости может зависеть не только от температуры, но и от концентраций как реагентов, так и продуктов реакции а также от присутствия посторонних веществ.
Порядок реакции по веществам никак не связан со стехиометрическими коэффициентами в уравнении реакции (хотя он может и совпадать). Численные значения порядков реакции могут быть любыми, в том числе нулевыми, дробными, отрицательными.
Кроме того, в отличие от простых реакций, в кинетическое уравнение сложных реакций могут входить концентрации и продуктов реакции и посторонних с точки зрения стехиометрического уравнения веществ.
Нахождение эмпирического уравнения и определение экспериментальных порядков реакции по отдельным компонентам реакционной смеси является очень важным начальным этапом в установлении наиболее вероятного механизма сложной химической реакции. Они также играют определяющую роль при выборе оптимального режима протекания реакции в производственных условиях.
Скорость простой химической реакции – это число элементарных актов, выраженных в молях, происходящих в единицу времени в единице реакционного пространства.
Реакционное пространство - это часть пространства, которое ограничено контрольной поверхностью и заключает внутри себя составляющие вещества – реагенты, интермедиаты и продукты, а также инертные по отношению к данной реакции компоненты. Реакционная система (реакционное пространство) может быть открытой или закрытой. Если на закрытую систему наложено дополнительное условие постоянства объема, то такая система статическая. Полагаем, что химическая реакция протекает при постоянной температуре в термически однородной системе.
Скорость элементарной реакции w 
Скорость изменения чисел молей компонента k в данной элементарной реакции (или скорость расходования исходного вещества, или скорость накопления продукта реакции):
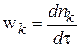
Но известно, что 
То есть между скоростью элементарной реакции и скоростью расходования компонента имеется связь

Скорость простой гомогенной химической реакции при постоянном объеме (или плотность скорости), которую чаще всего и используют в практических расчетах, определяется следующим образом:
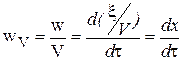

Основной постулат химической кинетики, или закон скорости, или закон действующих масс для кинетики (Гульдберг и Вааге).
wv = 
Молекулярность реакции - это число частиц, принимающих участие в элементарном акте химического превращения. Реакции бывают мономолекулярными, бимолекулярными и тримолекулярными.
k - константа скорости реакции.
Принцип независимости протекания реакций
 wv ,r
wv ,r
где r - число реакций, протекающих в системе с участием k компонентов.
Например  ;
;  ;
; 
 w1 + w2;
w1 + w2; 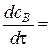 w1 - w2 - 2w3.
w1 - w2 - 2w3.
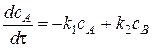 ;
; 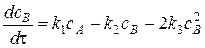
Кинетические уравнения для сложной реакции:
a 1 A 1 + a 2 A 2 = a 3 A 3 + a 4 A 4.
wv,эксп = k эксп 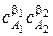 .
.
Для сложных реакций  не всегда равен
не всегда равен 
Показатель степени при концентрации исходного вещества, в уравнении скорости называется частным порядком реакции по этому веществу. Сумма всех частных порядков по компонентам называется общим или суммарным порядком реакции.
Молекулярность - число частиц, одновременно взаимодействующих в элементарном акте.
1. CH3N2CH3 ® C2H6 + N2;
A ® продукты 
2. 2HI ® H2+I2
2A ® продукты 
CH3COOH + C2H5OH ®CH3COOC2H5+ H2O
A1+ A2 ® продукты 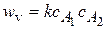
3. 2NO + H2 ® N2O + H2O
2A1 + A2 ® продукты 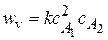
Порядок реакции - показатель степени у концентрации в кинетическом уравнении.

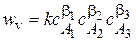
 - частный порядок реакции по компоненту k.
- частный порядок реакции по компоненту k.
COCl2 ®CO + Cl2 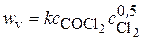
H2 + Br2 ® 2HBr 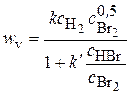
Реакции нулевого порядка - омыление водой малорастворимых в воде сложных эфиров в присутствии эфирного слоя. Фотохимические реакции
Реакции первого порядка - изомеризация, термическое разложение.
Реакции второго порядка - взаимодействие иода с водородом, омыление ацетоуксусного эфира щелочью.
Реакция третьего порядка - восстановление оксида азота водородом
|
|
Дата добавления: 2014-01-11; Просмотров: 3539; Нарушение авторских прав?; Мы поможем в написании вашей работы!