
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость константы скорости от температуры
|
|
|
|
Мы разобрали, как скорость реакции зависит от концентрации веществ и можно увидеть, что повышение концентрации реагента не самый практичный способ ускорения химической реакции. Значительно больший эффект достигается за счет повышения температуры реакции. Тут справедливо правило Вант-Гоффа, которое заключается в том, что при нагревании на 10 оС скорость большинства химических реакций увеличивается в 2 - 4 раза.
Математически это означает, что скорость реакции зависит от температуры степенным образом:

 - температурный коэффициент скорости.
- температурный коэффициент скорости.
Чувствительность скорости к температуре определяется только лишь зависимостью константы скорости от температуры.
Влияние температуры на скорость реакции с середины 19 века была объектом пристального внимания ученых, Первой удачной попыткой описать эту зависимость эмпирическими уравнениями следует считать уравнение, предложенное Бертло в 1862 году
 .
.
Именно к этому уравнению стали применять выражение: «Экспоненциальная зависимость скорости реакции от температуры».
Лишь в 1884 году Я.Вант-Гофф придал этой зависимости современную форму

Правда это уравнение теперь известно, как уравнение Аррениуса, но впервые вывел его именно первый нобелевский лауреат по химии Вант-Гофф.
Это уравнение содержит два параметра, характеризующих химическую реакцию:
 - предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции и E -энергию активации.
- предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции и E -энергию активации.
Энергия активации – это некоторая пороговая энергия, характеризующая высоту энергетического барьера на пути реакции.
Энергия активации для большинства реакций также не зависит от температуры.
|
|
|
Именно потому, что сам Вант-гофф не придал величине Е какого-то особого физического смысла, а это сделал спустя пять лет С.Аррениус, уравнение и носит имя Аррениуса.
Аррениус предположил, что реагировать между собой могут не все молекулы, а лишь те, которые находятся в особой активной форме – активные молекулы, возникающие эндотермически, т.е. при поглощении энергии активации Еа. Доля таких активных молекул очень невелика и приближенно может быть оценена множителем Больцмана

Поскольку величины энергий активации обычно лежат в интервале от 10 до 100 кДж/моль, то для среднего значения 50 кДж/моль эта доля составляет 6×10-6, при 500 К.
Рассмотрим вывод уравнения, приведенный в свое время Аррениусом.
Аррениус предположил, что в реакцию вступают не все молекулы, а только активные, причем между активными молекулами и обычными молекулами существует равновесие, а вот продукты получаются из активных молекул необратимо, то есть схема процесса:
А 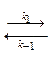 А *
А *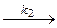 продукты
продукты
Активные молекулы образуются из обычных при поглощении энергии Еа. Константа скорости превращения активных молекул в продукты по Аррениусу не зависит от температуры, т.е. роль температуры, таким образом, сводится к сдвигу равновесия
А 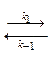 А *
А *
в ту или иную сторону.
Скорость реакции определяется концентрацией активных молекул, т.е.

В условиях равновесия эту концентрацию можно выразить через константу равновесия:

Теперь получим уравнение скорости
 , где эффективная константа скорости
, где эффективная константа скорости

Раз  не зависит от температуры, то температурная зависимость константы скорости реакции будет определяться уравнением изохоры Вант-Гоффа:
не зависит от температуры, то температурная зависимость константы скорости реакции будет определяться уравнением изохоры Вант-Гоффа:
 ,
,
где  - тепловой эффект реакции активации при постоянном объеме, который и называют энергией активации.
- тепловой эффект реакции активации при постоянном объеме, который и называют энергией активации.
Интегрируя уравнение, получают уравнение Аррениуса.
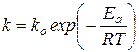
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1691; Нарушение авторских прав?; Мы поможем в написании вашей работы!