
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мономолекулярные обратимые реакции
|
|
|
|
Кинетика сложных гомогенных реакций
При рассмотрении кинетики сложных реакций делается допущение о том, что все элементарные реакции (стадии), составляющие сложную реакцию, протекают независимо друг от друга. Иначе говоря, максвелл-больцмановское равновесное распределение молекул по скоростям не нарушается, т.е. то нарушение, которое неизбежно привносится в систему при химическом превращении молекул с высокими скоростями (энергиями), очень быстро восстанавливается в процессе хаотического теплового движения молекул.
Задачи, решаемые в формальной кинетике, делятся на прямые и обратные. В прямых задачах по известным значениям кинетических параметров сложной реакции находят уравнения кинетических кривых, в обратных, наоборот, по кинетическим кривым (опытным) находят кинетические параметры, механизм реакций, порядок стадий, значение констант скоростей.
Рассмотрим формальную кинетику для сложных гомогенных реакций в закрытых системах.
Двусторонние элементарные реакции первого порядка состоят из прямой и обратной элементарной реакций первого порядка:

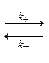
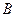
К таким реакциям относятся, например, изомерные превращения в различных классах органических соединений.
Приведенную выше реакцию можно записать отдельно по стадиям:
1. 
Константу скорости этой стадии (называемой прямой стадией) обозначим  ,
,
2. 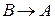 с константой скорости, соответственно,
с константой скорости, соответственно, 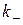 .
.
Скорость каждой из стадий равна соответственно
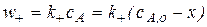

Скорость двусторонней реакции равна разности скоростей прямой и обратной элементарных реакций:
 ,
,
а с другой стороны скорость реакции можно выразит через плотность глубины реакции:
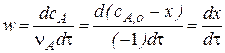
Решая эти уравнения совместно, получим:

В результате получаем дифференциальное кинетическое уравнение двусторонней реакции первого порядка.
Преобразуем его:
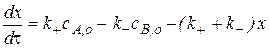
При достижении равновесия скорость прямой реакции становится равной скорости обратной реакции, то есть общая скорость равна нулю:
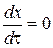
При этом плотность глубины реакции обозначается 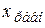 .
.

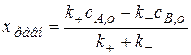
Теперь дифференциальное кинетическое уравнение имеет вид
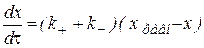
Оно по форме напоминает дифференциальное уравнение просто реакции первого порядка:
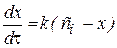
только вместо одной константы имеем сумму констант скоростей, а вместо начальной концентрации - равновесную плотность глубины реакции. Найдем решение этого уравнения:
Разделим переменные, и, обозначив сумму констант скоростей прямой и обратной стадий как  , получим после интегрирования:
, получим после интегрирования:

Сумму констант из этого уравнения можно найти расчетным методом, либо графически, обрабатывая данные по эксперименту следующим образом:
1. Получить кинетическую кривую.
 |
2. Определить графически величину равновесной плотности глубины реакции.
3.Подготовить соответствующие данные и построить график в координатах:

Чтобы найти каждую из констант скоростей реакций по отдельности, выразим, чему равна константа равновесия данной реакции:

Решая совместно последние два уравнения, получим:
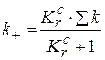

Таким образом, обратная кинетическая задача решена.
Чтобы решить прямую задачу кинетики, то есть получить теоретическое выражение зависимости концентраций 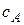 и
и  от времени, нужно выразить в явном виде зависимость концентраций
от времени, нужно выразить в явном виде зависимость концентраций
веществ А и В от времени
Сначала выразим плотность глубины реакции:

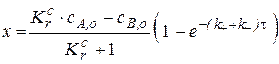
Зная, что в любой момент времени концентрации веществ связаны с начальными концентрациями соотношениями:
 и
и 
легко получить желаемые соотношения.
Вывести самостоятельно.
Несколько общих замечаний:
1.Следует отметить, что практически для любой двусторонней реакции существует некоторый начальный промежуток времени, когда величина глубины протекания реакции мала и двустороннюю реакцию можно рассматривать как одностороннюю.
2.Если скорости прямой и обратной реакций вообще несопоставимы, например,  , то двустороннюю реакцию можно считать практически односторонней (прямой) практически во всем интервале времени протекания реакции. Обычно при этом наблюдаются большие значения константы скорости прямой реакции, большие начальные концентрации вещества А и большая величина константы равновесия.
, то двустороннюю реакцию можно считать практически односторонней (прямой) практически во всем интервале времени протекания реакции. Обычно при этом наблюдаются большие значения константы скорости прямой реакции, большие начальные концентрации вещества А и большая величина константы равновесия.
3. С другой стороны при приближении к концу любой реакции, то есть через бесконечно большое время, все абсолютно реакции становятся обратимыми и скорости прямой и обратной реакции становятся соизмеримыми, то есть можно сказать, что реакция односторонняя только если скорость прямой реакции гораздо больше скорости обратной и кроме того, эта реакция находится далеко от равновесия.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1286; Нарушение авторских прав?; Мы поможем в написании вашей работы!