
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика простых реакций в открытых системах
|
|
|
|
В лабораторной практике и в промышленности реакции проводят в статических системах с постоянным объемом где отсутствует массообмен с внешней средой. Это системы периодического действия, куда сначала загружают все компоненты, а после завершения процесса извлекают продукты и непрореагировавшие исходные вещества. Такая технология в основном используется для малотоннажных производств.
Для многотоннажных производств химические процессы проводят в системах открытых - в реакторах проточного типа, на вход которых непрерывно подается сырье, а на выходе отбирается целевой продукт. Эти реакторы имеют значительно большую производительность.
Реакторы открытого типа могут работать в различных режимах. Однако можно выделить два предельных случая: режим полного перемешивания и режим идеального вытеснения.
Реактор идеального смешения (безградиентная реакционная система)
Пусть в такой реактор объемом V, заполненный чистым растворителем, в момент времени 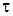 =0 начинают подавать раствор реагента А с концентрацией
=0 начинают подавать раствор реагента А с концентрацией 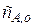 , причем объемная скорость подачи равна u. Одновременно из реактора, где происходит полное перемешивание поступающего раствора, выводится с той же объемной скоростью раствор с концентрацией оставшегося непревращенного реагента
, причем объемная скорость подачи равна u. Одновременно из реактора, где происходит полное перемешивание поступающего раствора, выводится с той же объемной скоростью раствор с концентрацией оставшегося непревращенного реагента 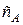 .
.

Схема безградиентного реактора.
Благодаря полному перемешиванию концентрация вещества в любой его точке такая же, как и на выходе из него.
Скорость изменения общего количества (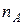 ) исходного вещества, содержащегося в реакторе, определится условиями материального баланса.
) исходного вещества, содержащегося в реакторе, определится условиями материального баланса.
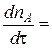 u
u 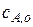 - u
- u 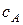 - wv V
- wv V
wv,A - скорость химической реакции, отнесенная к единице объема реактора. Разделив обе части уравнения на V, получим:
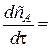
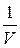 (u
(u 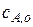 - u
- u 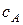 ) - wv
) - wv
Отсюда, скорость реакции может быть выражена:
wv = 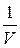 (u
(u 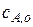 - u
- u 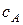 ) -
) - 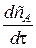 .
.
С другой стороны, если протекает реакция первого порядка, то скорость ее равна
wv =
Получаем дифференциальное уравнение
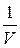 (u
(u 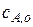 - u
- u 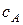 ) -
) - 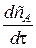 =
= 
Уравнение решается разделением переменных при начальных условиях  и
и  . Интегрирование в пределах от
. Интегрирование в пределах от  до
до 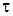 дает
дает
 .
.
Уравнение передает зависимость концентрации вещества от времени при заданной скорости подачи реакционной смеси и объеме реактора. Из этого уравнения следует, что концентрация А в реакционном пространстве постепенно возрастает и при некотором времени достигнет постоянного значения 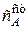 - стационарной концентрации реагента
- стационарной концентрации реагента
 u
u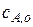 /(u+kV)
/(u+kV)
То есть открытые системы обладают очень интересным свойством выходить на стационарный режим.
Можно определить время выхода проточного химического реактора на стационарный режим (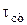 ). Для этого уравнение (3.12) нужно представить в виде
). Для этого уравнение (3.12) нужно представить в виде
 .
.
Далее нужно задать критерии выхода реактора на стационарный режим (Р):
 .
.
Отсюда следует, что  .
.
Пример 1.
Рассчитаем время выхода на стационарный режим реактора идеального смешения при следующих значениях начальных условий:
Константа скорости протекающей в реакторе реакции k = 1 с-1; объем реактора 1 м3; скорость подачи реагентов 0, 1 м3/с; критерий выхода реактора на стационарный режим P = 0,99.
В этом случае
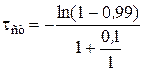 = 4,19 с.
= 4,19 с.
Уравнение позволяет рассчитать также скорость подачи реакционной смеси для достижения на выходе из реактора определенной концентрации исходного вещества.
Пример 2. Какова должна быть объемная скорость подачи реагента для того, чтобы концентрация на выходе составляла 10 % от начальной, если в реакторе V = 1 м3 протекает реакция первого порядка с константой скорости
 = 1 с-1.
= 1 с-1.
По условию задачи  .
.
Т.е. 0,1 = u/(u+kV), отсюда u= 0,111 м3/с.
Производительность реактора равна u ( = 0,1 моль/с.
= 0,1 моль/с.
В промышленности стараются достичь как можно более полного превращения реагента, для чего используют каскад реакторов.
Пример 3. Рассчитаем, какую долю от начальной будет составлять концентрация реагента на выходе из третьего реактора, расположенного в каскаде, при скорости подачи раствора v= 0,11 м3/с, объеме реактора V = 1 м3 с протекающей в нем реакцией первого порядка с константой скорости  = 1 с-1.
= 1 с-1.
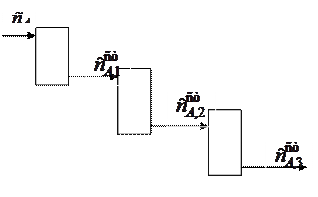
На выходе из первого реактора  u
u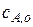 /(u +kV).
/(u +kV).
Это начальная концентрация для второго реактора, т.е. на выходе из второго реактора будем иметь
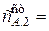 [ u /(u+kV)]2
[ u /(u+kV)]2 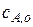 .
.
Эта стационарная по второму реакторы концентрация будет начальной для третьего реактора, т.е. стационарная по третьему реактору концентрация будет равна
 [ u/(u+kV)]3
[ u/(u+kV)]3 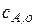
 0,001
0,001 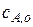 .
.
Изменение концентрации реагента А со временем в реакторе полного смешения имеет вид

Для определения величины константы скорости реакции из экспериментальных данных исследуют зависимость степени превращения в стационарном режиме от объемной скорости.
При расчете полезна величина 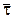 - среднее время пребывания частиц в реакторе идеального смешения
- среднее время пребывания частиц в реакторе идеального смешения
 / v.
/ v.
хотя конечно, в действительности время пребывания различных частиц неодинаково. Одни частицы при перемешивании быстро уносятся потоком к выходу, а другие долгое время перемещаются внутри аппарата.
Для рассматриваемой реакции первого порядка 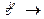 продукты.
продукты.
можно записать баланс по веществу А при стационарном процессе:
с использованием понятия среднего времени пребывания частицы в реакторе:

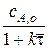
Кроме того вводится понятие: степень превращения исходного вещества А при выходе реакционной смеси из реактора идеального смешения:

Помня о том, что такое среднее время пребывания молекул в реакторе, видно, что если построить зависимость в координатах «обратная степень превращения - объемная скорость подачи реагента», можно найти значение константы скорости реакции.
Можно найти и стационарную концентрацию продукта реакции. Например, пусть будет единственный продукт В.
Число молей во время реакции не изменяется, то есть
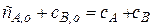
Отсюда 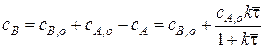
Обычно 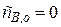 .
.
При проектировании такого реактора нужно выразить среднее время пребывания реакционной смеси в аппарате через степень превращения:
Из уравнения 
Объем аппарата найдем как V = 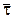 u
u
Реактор идеального вытеснения (проточный реактор)
Их обычно используют при исследовании газо- или парофазных процессов.

Схема реактора идеального вытеснения
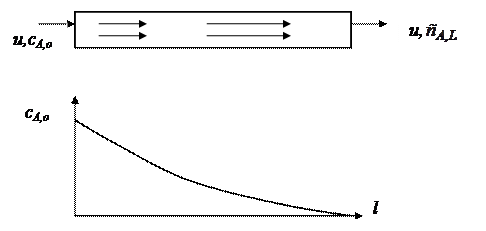
Изменение концентрации исходного вещества вдоль реактора идеального вытеснения для реакции первого порядка, протекающей без изменения реакционного объема
В стационарном состоянии, которое для этих реакторов достигается очень быстро, вдоль реактора устанавливается постоянный во времени профиль концентраций, зависящий только от расстояния l от входа в реактор. В этом реакторе реакционная смесь движется так, что перемешивание вдоль реактора отсутствует, т.е некоторый элемент объема Sdl
(S- сечение реактора, dl – элемент длины) движется как поршень в цилиндре. Так как реакционная смесь непрерывно подается и выводится из реактора, то в нем устанавливается стационарное состояние. При этом концентрация реагента будет меняться от начальной в начале реактора до какой-то конечной на выходе. Через левое сечение в элемент объема за единицу времени входит u× 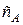 молей вещества, а через правое сечение выходит u
молей вещества, а через правое сечение выходит u  молей вещества. Так как режим стационарный, то уменьшение количества вещества в элементе объема происходит только за счет протекания реакции, следовательно,
молей вещества. Так как режим стационарный, то уменьшение количества вещества в элементе объема происходит только за счет протекания реакции, следовательно,
u 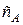 - u
- u  = wv,A S dl.
= wv,A S dl.
Отсюда следует, что
wv,A =  .
.
Следовательно для скорости реакции можно записать
wv = -  .
.
Если рассматриваемая реакция относится к первому порядку, то
-  = k cA
= k cA
После разделения переменных получим

Отсюда концентрация реагента на выходе из реактора
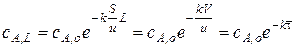
Это уравнение позволяет рассчитать скорость подачи реагента при заданной концентрации его на выходе из реактора.
Пример 4. Какую объемную скорость подачи реагента нужно задать в реакторе идеального вытеснения, чтобы при его объеме V = 1 м3 с протекающей в нем реакцией первого порядка с константой скорости  = 1 с-1 добиться уменьшения концентрации реагента с 1 моль/ м3 до 0, 1 моль/м3.
= 1 с-1 добиться уменьшения концентрации реагента с 1 моль/ м3 до 0, 1 моль/м3.
Ответ: u= 0,43 м3/с.
Если сравнить эти результаты с расчетами для реактора идеального смешения, то видно, что реактор идеального вытеснения более эффективен, поскольку при одинаковой степени превращения скорость подачи реагента в нем выше примерно в 4 раза.
И для реактора идеального вытеснения вводится понятие степени превращения:

Пример 5. Сравним степени превращения, которые достигаются в стационарном состоянии при проведении одной и той же реакции в реакторе полного перемешивания и в реакторе идеального вытеснения.
В реакторе полного перемешивания
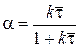
В реакторе идеального вытеснения

Пусть степень превращения равна 0,5.
Выразим время полупревращения реакции
в случае реактора полного перемешивания

В случае реактора идеального вытеснения
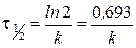 .
.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1742; Нарушение авторских прав?; Мы поможем в написании вашей работы!