
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярна електрична провідність
|
|
|
|
Молярна електрична провідність розчину - міра електричної провідності всіх іонів, які утворюються при дисоціації 1моль електроліту за даної концентрації. Чисельно вона дорівнює електропровідності розчину, розміщеного між двома паралельними електродами з міжелектродною відстанню 1см, площа яких така, що обмежує розчин, в якому знаходиться 1моль розчиненої речовини
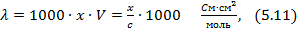
де 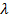 - молярна електрична провідність,
- молярна електрична провідність, 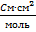 ;
;
С – концентрація розчину, моль/л;
V – розбавлення розчину л, моль.

При нескінченному розбавлені розчину, молярна електропровідність наближається до граничного значення λ∞ – стала величина, яка дорівнює:
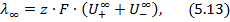
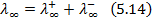
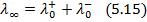
λ0 – гранична рухливість
Значення молярної електропровідності іонів наведені в довіднику. Найбільшу молярну електропровідність мають іони:протони (H3O+ = 349,8 у вигляді іонів гідроксонію) і гідроксид-іони – відповідно 349,8 та 198,3 См·см2/моль, тоді як для інших іонів вона значно менша – для Na+ - 50.1, для Cl- - 76,4. Гранична рухливість λ0 залежить від природи розчинника та концентрації розчину. Для протонів Н+ λ0:349,8 (вода); 143(метанол); 88(ацетон); 59(етанол); 23(нітробензол); λ(за різних концентрацій, моль/л):314,2(0,001);307,0(0,01); 294,4(0,1)
Така аномально висока молярна електропровідність обумовлена тим, що поряд з міграцією Н+ і ОН- відбувається естафетний механізм переміщення цих іонів від однієї молекули води до іншої у напрямі поля.
Пряма кондуктометрія – метод не специфічний, оскільки величина електропровідності залежить від присутніх у розчині іонів.
Пряму електропровідність використовують:
- Для визначення вмісту солей у воді;
- Для встановлення ступеню регенерації іонітів;
- Для розрахунку окремих фізико-хімічних характеристик сполук і розчинів: констант дисоціації слабких електролітів, ступені дисоціації слабких електролітів, добутку розчинності малорозчинних сполук, констант стійкості комплексів.
Крім того, на кондуктометрії використовують в якості детекторів у газовій хроматографії, для визначення вологості повітря, для встановлення вмісту H2S, NOx, CO, CH4 у вихлопних газах автомобільного транспорту.
Уреазний біосенсор використовують для визначення вмісту сечовини в біологічних об’єктах, а також вмісту катіонів важких металів, які зменшують активність ферменту. Дія біосенсора ґрунтується на гідролізі сечовини під дією уреази.
CO(NH2)2+H2O → 2NH4++CO32-
Концентрацію сечовини визначають за величиною електропровідності розчину, обумовленої йонами NH4+і CO32-.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 5022; Нарушение авторских прав?; Мы поможем в написании вашей работы!