
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тепловое расширение твердых тел
|
|
|
|
Рассмотрим тепловое расширение тел, связанное с ангармонизмом колебаний кристаллической решетки. В тепловом расширении проявляется универсальное свойство нелинейных систем. Реальные колебательные системы являются нелинейными: при увеличении амплитуды колебаний происходит изменение основного состояния. Тепловое расширение, в отличие, например, от теплопроводности, во всех веществах, включая и металлы, обусловлено в основном кристаллической решеткой.
При повышении температуры возрастает интенсивность тепловых колебаний атомов в узлах кристаллической решетки. В результате увеличиваются межатомные расстояния и линейные размеры кристалла. Механизм теплового расширения, очевидно, напрямую связан с природой межмолекулярных взаимодействий.
Силы взаимодействия атомов и молекул сводятся к кулоновскому притяжению и отталкиванию положительно заряженных атомных ядер и отрицательных электронов. К ним относятся, во-первых, химические и валентные силы. Эти силы действуют на близких расстояниях. Они связаны с противоположной ориентацией спинов атомных ядер и определяются степенью перекрытия электронных волновых функций атомов. Так как плотность размывания электронного облака убывает экспоненциально с увеличением расстояния от центра атома, то и химические силы убывают экспоненциально с возрастанием расстояния между атомами.
Во-вторых, к молекулярным силам относятся короткодействующие силы отталкивания, возникающие при проникновении электронных оболочек взаимодействующих частиц при их сближении. Такие силы также экспоненциально убывает с расстоянием между взаимодействующими частицами и притом очень быстро. Это позволяет, например, в кинетической теории газов пользоваться упрощенной моделью молекул и атомов, заменяя их твердыми упругими шарами.
В-третьих, существуют силы притяжения противоположно заряженных ионов. Ясно, что это имеет место только в кристаллах, решетка Браве которых содержит двух и более атомный базис, включающий в себя положительные и отрицательные ионы.
В-четвертых, и между нейтральными атомами и молекулами действуют также силы притяжения. Они убывают с расстоянием не по экспоненциальному, а по степенному закону, т.е. значительно более медленно. В отличие от короткодействующих сил, их можно назвать дальнодействующими. Эти силы возникают при взаимодействии электрических дипольных моментов атомов и молекул или при деформации их электронных оболочек. Если молекулы полярные, то наличие такого взаимодействия очевидно. Однако взаимодействие существует, и даже, как правило, превосходит взаимодействие полярных молекул. Эти силы называются силами Ван-дер-Ваальса, или дисперсионными. Природа этих сил – чисто квантовая. Дело в том, что у возбужденных атомов и молекул проявляются дипольные моменты, хотя и быстро изменяющиеся со временем. Но если молекула или атом не возбуждены, то с точки зрения классической физики дипольных моментов у них не должно быть.
В квантовой же механике дело обстоит иначе. У невозбужденных атомов или молекул есть нулевая энергия, которой соответствуют весьма интенсивные нулевые колебания. С наличием этих колебаний и связано происхождение сил Ван-дер-Ваальса. Нулевые колебания не связаны с тепловым движением, поэтому и силы Ван-дер-Ваальса не зависят от температуры.
Рассмотрим цепочку близко расположенных молекул, в которых за счет нулевых колебаний возникли осциллирующие дипольные моменты. При этом возможны различные варианты взаимного расположения зарядов внутри молекул. Когда молекулы обращены друг к другу разноименными зарядами (рис. 5.5а), то наблюдается притяжение между ними.
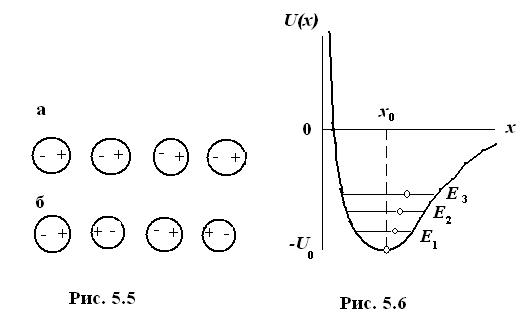
В этом положении потенциальная энергия взаимодействия молекул минимальна. Если же молекулы обращены друг к другу одноименными зарядами (рис. 5.5б), то наблюдается их отталкивание, и энергия взаимодействия максимальна. Первому положению соответствует устойчивое равновесие, второму – неустойчивое. Согласно распределению Больцмана, при термодинамическом равновесии первое положение более вероятно (в нем система проводит больше времени), а второе положение менее вероятно (в нем система проводит меньше времени). В итоге результирующим эффектом будет притяжение молекул.
Приведем некоторые общие заключения для сил межмолекулярного взаимодействия:
- все механизмы обусловлены электрическим (кулоновским) взаимодействием;
- как правило, различные механизмы связи действуют одновременно, но их относительные вклады в разных веществах могут сильно различаться.
Типичная кривая зависимости потенциальной энергии взаимодействия атомов U (x) от расстояния х между ними представлена на рис. 5.6. При больших х потенциальная энергия стремится к нулю, а при уменьшении х также уменьшается, что указывает на наличие сил притяжения. Когда х становится меньше х 0 (положение равновесия), кривая круто поднимается вверх, что соответствует наличию сил отталкивания. На горизонтальных линиях Е 1, Е 2, Е 3, соответствующих значениям полной энергии при разных температурах (Т 1 < Т 2 < Т 3), кружочками отмечены равновесные расстояния между атомами. Отчетливо видно, что в силу несимметричности зависимости U (x) при повышении температуры растет и среднее расстояние между атомами, что и приводит к тепловому расширению. В гармоническом приближении среднее расстояние между атомами не зависело бы от амплитуды колебаний, и ни о каком тепловом расширении не было бы и речи.
Приведем без вывода выражение для коэффициента линейного расширения ɑl:
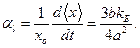
Его численное значение определяется постоянной Больцмана и коэффициентами ɑ и b, которые входят в разложение U (x) вблизи минимума и определяются конкретным видом кристаллической решетки. Из физических соображений следует, что коэффициент ɑ (его иногда называют коэффициентом гармоничности), положителен, а вот коэффициент b (коэффициент ангармоничности) может иметь любой знак. Если b > 0 (для рассматриваемого диапазона температур), то при нагревании тело расширяется. Такая ситуация наблюдается очень часто. Если же b < 0, то при повышении температуры объем тела, как это ни странно, уменьшается. Прекрасной иллюстрацией данного факта является поведение воды в диапазоне температур от нуля до 4оС. Таким же свойством обладают и некоторые композиционные материалы, созданные исскуственно.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1366; Нарушение авторских прав?; Мы поможем в написании вашей работы!