
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метастабильные фазы. ДФР с метастабильными фазами
|
|
|
|
Другим важным примером отклонения от равновесия является образование в процессе фазовых превращений метастабильных фаз. Так называют неравновесные фазы, представляющие собой в одних случаях:
а) переходную стадию между исходной фазой и равновесной,
в других -
б) фазу, устойчивую при определенных соотношениях давления, температуры и концентраций.
На диаграммах фазовых равновесий метастабильные равновесия изображаются штриховыми линиями.
Метастабильные фазы образуются при кристаллизации элементарных веществ и двойных сплавов при значительном переохлаждении расплавов (растворов), при этом температурно-концентрационная область, в которой эти фазы являются метастабильными, имеет разную протяженность. Изобарно-изотермный потенциал у метастабильной фазы меньше, чем у исходной, но больше, чем у равновесной фазы, поэтому превращение метастабильной фазы в равновесную требует определенной энергии активации, при отсутствии которой метастабильная фаза может существовать сколь угодно долго.
Образование метастабильных фаз - явление, часто наблюдаемое и широко используемое и при превращениях в твердом состоянии. Сюда относится, прежде всего, образование пересыщенных твердых растворов, если их распад осуществляется при низких температурах, когда диффузия и соответственно образование равновесных фаз затруднены.
Есть все основания предполагать, что наблюдающееся в сильно легированных полупроводниках несовпадение концентрации электрически активной примеси и ее общей (химической) концентрации (политропия примеси) является в ряде случаев результатом начальных стадий распада твердого раствора, в процессе которого с участием примеси образуются метастабильные фазы.
Метастабильные фазы образуются также при резком охлаждении твердых растворов, которые должны в равновесных условиях охлаждения испытывать эвтектоидное превращение. Иллюстрацией этого является мартенситное превращение при закалке стали (аустенита). Многие из метастабильных состояний обусловливают в сплавах полезные, а иногда и уникальные свойства. Цель материаловедения - установление природы этих неравновесных состояний и разработка принципиальных режимов, позволяющих получить метастабильные состояния. Исходным моментом при решении этих задач является знание диаграмм фазовых равновесий.
Для описания метастабильных фаз используют специальные диаграммы фазовых равновесий метастабильных фаз - так называемые метастабильные диаграммы. Области метастабильности и метастабильные химические соединения на таких диаграммах показывают штрихованной линией. Вопрос о применении правила фаз к метастабильным диаграммам является дискуссионным. На рис. 9.3 приведены диаграммы фазового равновесия систем Со-С и Ni-С и метастабильные диаграммы этих систем.
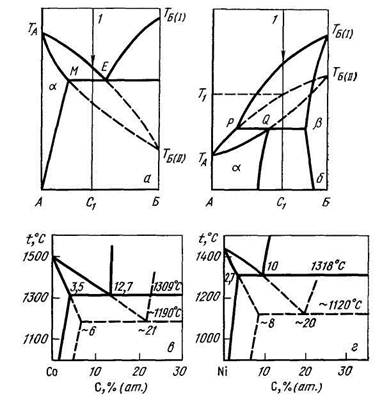
| Рис. 9.3. Метастабильные диаграммы (сплошные линии – стабильное, штрихованные – метастабильное равновесия): а – возможные метастабильные равновесия в диаграмме эвтектического типа; б - возможные метастабильные равновесия в диаграмме перитектического типа; в – метастабильная диаграмма системы Со-С; г – метастабильная диаграмма системы Ni-C. |
Величина метастабильности определяется разностью между энергиями метастабильной фазы и смеси стабильных фаз. При очень больших скоростях охлаждения (102 – 1010) К /с из переохлажденных расплавов (растворов) ниже определенной температуры можно получить твердые метастабильные фазы не только в кристаллическом, но и в аморфном состоянии (когда в фазе есть ближний порядок и отсутствует дальний порядок в расположении атомов). Сплавы в аморфном состоянии можно получать не только при кристаллизации из жидкой фазы, но и при осаждении из газовой фазы. Для получения в аморфном состоянии фаз с ковалентным типом связи требуются меньшие скорости охлаждения, по сравнения с фазами с металлическим типом связи.
Знать диаграмму фазовых равновесий необходимо также при выборе составов жидкой фазы и температурных условий кристаллизации. Это особенно важно при получении кристаллов соединений. Рассмотрим это на примере получения монокристаллов вытягиванием их из жидкой фазы по методу Чохральского.
Кристаллизация происходит на кристалле–затравке, соприкасающемся с поверхностью жидкого расплава, переохлажденного на ∆ T ниже температуры ликвидуса. Это переохлаждение поддерживается в течение всего процесса кристаллизации. По мере кристаллизации новых слоев твердой фазы на затравке кристалл вытягивают из жидкой фазы. Состав кристаллизующейся твердой фазы определяется диаграммой фазового равновесия, если в процессе вытягивания поддерживаются условия, близкие к равновесным (скорость кристаллизации мала, широко развиты процессы диффузии в твердой и жидкой фазе, т.е. ∆ Т →0).
Конгруэнтно плавящиеся соединения, например GaTe и Ga2Te3 (см. рис. 8.2 а, л. 8), можно получать из жидкой фазы того же состава, что и состав соединения. Их можно получать и кристаллизацией из расплава несколько отличающегося состава: например, соединение GaTe – из расплава состава Х 1 кристаллизацией при какой-либо из температур в интервале между 1100 и 1019 К. Однако при этом следует учитывать, что если соединение обладает определенной областью гомогенности, то вытягиваемый кристалл не будет иметь стехиометрического состава, а будет представлять собой твердый раствор предельной концентрации на основе этого соединения, равновесный для температуры кристаллизации.
Инконгруэнтно плавящиеся соединения нельзя получать из жидкой фазы того же состава. Так, на рис. 8.2, л. 8 видно, что из жидкой фазы, отвечающей составу GaTe3 при переохлаждении ниже линии ликвидуса, будет кристаллизоваться твердая фаза состава Ga2Te3, а не GaTe3. Чтобы при кристаллизации из жидкой фазы выделялось конгруэнтно плавящееся соединение GaTe3, состав жидкой фазы должен лежать в интервале концентрации от Х 2 до Х 3, а кристаллизацию следует вести при температуре в интервале между Т 3 (~760 К) и Т 4 (709 К). Рассмотренную выше кристаллизацию инконгруэнтно плавящегося соединения принято называть кристаллизацией из раствора.
В отличие от этого кристаллизацию из жидкой фазы, отвечающей по составу кристаллизуемой твердой фазе, называют кристаллизацией из расплава. Вообще, понятия «расплав» и «жидкий раствор» требуют уточнения. Под расплавом следует понимать жидкую фазу, состав которой по основному (основным) компоненту (компонентам) отвечает составу элементарного вещества или соединения в пределах точности их определения, и содержание фоновых примесей и легирующих добавок, в котором не превышает (1 – 2) % (ат.). Под жидким раствором следует понимать жидкую фазу, состав которой по основным компонентам не совпадает с составом твердой фазы, а также и такую жидкую фазу, содержание фоновых примесей и легирующих добавок в которой превышает (1 – 2) % (ат.).
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2384; Нарушение авторских прав?; Мы поможем в написании вашей работы!