
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стационарный и квазистационарный режим процесса. Лимитирующая стадия процесса. Динамика нестационарного процесса
|
|
|
|
Лекция 5. Тема. Организация медицинского обеспечения населения в чрезвычайных ситуациях
Лекция 4. Тема. Планирование действий по предупреждению и ликвидации чрезвычайных ситуаций, принимающих участие в ликвидации медико-санитарных последствий в режиме повседневной деятельности, повышенной готовности и Чрезвычайной Ситуации
Медицина катастроф
| Контрольный вопрос | Ответ |
| 1. Классификация и критерии чрезвычайных ситуаций - | Перечислить цели (кратко, но правильно) |
| 2. Классификация чрезвычайных ситуаций по масштабу их распространения - | |
| 3. Виды обстановки, которая может сложиться на территории лечебно-профилактического учреждения при ЧС - | |
| 4. Виды режимов функционирования РСЧС - | |
| 5. Пропаганда знаний в области защиты населения и территорий от чрезвычайных ситуаций (Статья 21) обеспечивается путем: | |
| 6. Перечень основных мероприятий в режиме повседневной деятельности - | |
| 7. Перечень основных мероприятий в режиме повышенной готовности | |
| 8. Перечень основных мероприятий в режиме чрезвычайной ситуации - | |
| 9. Общие положения и принципы планирования мероприятий на случай ЧС | |
| 10. Краткая структура плана действий по предупреждению и ликвидации чрезвычайных ситуаций - |
| Контрольный вопрос | Ответ |
| 1. В структуре потерь при ЧС по локализации - | |
| 2. В структуре потерь при ЧС по видам ЧС - | |
| 3. Основными целями планирования медицинского обеспечения населения в ЧС - | |
| 4. Способы защиты при ЧС - | |
| 5. Перечислите сигналы оповещения их кратку суть - | |
| 6. Перечислите коллективные средства защиты населения, их краткую характеристику- | |
| 7. Перечислите индивидуальные средства защиты населения, их краткую характеристику - | |
| 8. Перечислите медицинские средства защиты населения, их краткую характеристику - | |
| 9. Медицинские средства защиты от СДЯВ,ОВ: | |
| 10. К радиозащитным препаратам относятся | |
| 11. На медицинскую службу при проведении РЭН возлагаются задачи: : |
|
|
|
Согласно концепции (квази)стационарного состояния скорость накопления промежуточного соединения ( приблизительно) равна нулю; например, в схемах (R8 и 9) для В:d[B]/dt ~ 0. Продемонстрируем применение СС на примере (R8) и (R9).
Очевидно, что условие СС для R8 может реализоваться только в случае k1<<k3. Тогда уравнения (2.11) и (2.12) для безразмерных концентраций продуктов примут следующий простой вид:
yB = k1{exp(-k1t)}/k2) (2.23)
и
yD = 1- exp(-k1t) (2.24)
причем точность этого приближенного решения тем выше, чем меньше отношение k1/k2, как видно из рис. 10а и б, на которых приведены кинетические кривые a(t) и yB(t).
Используя этот подход для R9, т.е. принимая СС в случае
k-1 >> k1 и k2>k1, можно упростить решения (2.21) и (2.22):
b = k1{exp(-k1k2t/(k-1+k2)}/(k-1+k2) (2.25)
d = 1- {b•exp(-k1k2t/(k-1+k2)}/(k-1+k2) (2.26)
В стационарном состоянии системы можно использовать допущение олимитирующей стадии,т.е. предположение о том, что скорость суммарного процесса определяется скоростью наиболее медленной стадии этого процесса, например, стадия 2 для схемы R9. Тогда скорость этой стадии равна:
r2 = k2 [B] = k2K1[A] (2.27)
в этом случае
b = K1 exp(-K1k2t) (2.28)
d = 1- (1+K1)exp(-K1k2t) (2.29)
Следует отметить (аналогия с гидравликой), что до лимитирующей стадии происходит накопление вещества, а после ЛС все концентрации промежуточных соединений весьма малы. При наличии ЛС вся кинетическая информация относится только к этой медленной стадии. В сложном многостадийном процессе при наличии ЛС всегда реализуется стационарный режим. Действительно, в таком случае концентрации реагентов изменяются со скоростью медленной ЛС, а концентрации промежуточных соединений практически равновесны.
|
|
|
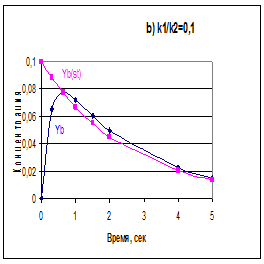
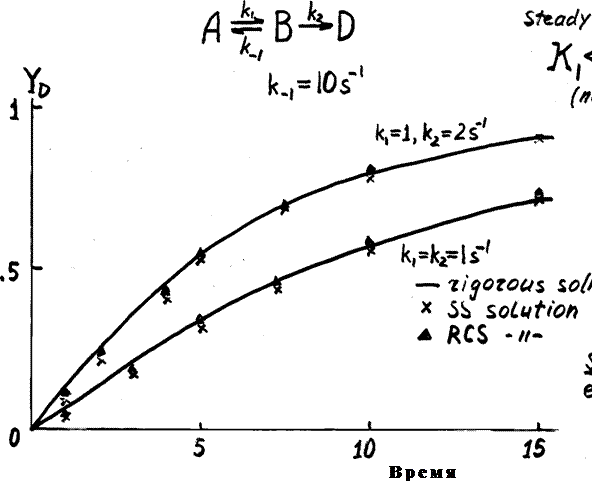
Кинетические кривые yB(t) и yB(st) показаны на рис. 11 (схема AàBàD) и рис. 12 (схема AóBÜD). На рис. 12 сопоставлены три решения кинетического уравнения для схемы R9: строгое, СС и ЛC.

| 
| |
| Рис. 11. Кинетические кривые для последовательной реакции; a) k2 = 0,8 с-1 b) k2 = 4,0 с-1; yB (точное решение), yB(st) стационарное приближение |
| |
Рис. 12. Кинетические кривые выхода продукта D для
параллельно-последовательной реакции 9, где K= 0,1; k1 = 1 c-1 и k2= 1 (2)
и 2 c-1 (1); ─ точное решение, ▲ - решение для СС и х - решение для ЛС
Отметим, что в случае, когда константа равновесия K1>1, СС дает неудовлетворительный результат вследствие быстрого превращения реагента в закрытой системе. Следовательно, для применения СС необходимо поддерживать концентрацию [A] ~ const, например, используя проточные реакторы.
Из рисунков 11 и 12 видно, что оба приближения дают удовлетворительное кинетическое описание, начиная с некоторого момента времени. Поэтому для надежного применения стационарного (квазистационарного) приближения следует рассмотреть динамику нестационарного процесса.
С этой целью вернемся к схеме R4 для сопоставления точного решения
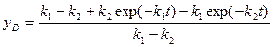 (2.9)
(2.9)
с решением в приближении СС при k 1/k2<1

 ŷD =
ŷD = 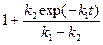 (2.23)
(2.23)
Найдем отношение
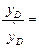
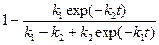 (2.29)
(2.29)
из которого оценим возможность реализации стационарного состояния, а также время достижения стационарного состояния с точностью 90%. Пусть k1/k2 = 0,5 и k2= 0,8 с-1, тогда tм= 1,73 с. Соответствующие данные приведены ниже:
| t, с | 1,5 | ||||||
| YD/ŷD | 0,808 | 0,857 | 0,895 | 0,943 | 0,971 | 0,999 |
Видно, что уже в окрестности tм величина ошибки стационарного приближения составляет около 11% и быстро снижается с увеличением времени (и глубины) реакции. Так при t> 3tм величины yD иŷD практически равны (см. рис. 12). Таким образом, стационарное приближение может быть использовано при соотношении констант стадий k 1/k2 < 1, начиная с момента достижения максимальной концентрации промежуточного соединения, tм.
В заключение укажем последовательность этапов разработки кинетического описания (модели) термодинамически возможного химического процесса:
|
|
|
· На первой стадии проводят экспериментальное исследование зависимости концентрации реагентов от времени реакции Ci(t),
· Рассчитывают начальную скорость реакции r0= dCi/dt, ( при малой конверсии)и исследуют зависимость r0(Ci) при различных температурах с целью определения значений порядка реакции по всем реагентам (mi) и значений наблюдаемой энергии активации.
· Применимость найденного порядка реакции проверяют путем расчета константы скорости, используя одно из уравнений в табл. 2.
· После нахождения констант скорости определяют энергию активации по уравнению Аррениуса. Найденные значения E и mi обычно сопоставляют с имеющимися в литературе, и в случае существенных различий, проводится дополнительный анализ причин таких расхождений.
Окончательно кинетическое уравнение реакции (например 1) имеет вид:
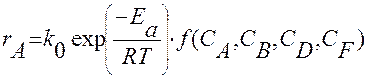 (2.30)
(2.30)
Это уравнение можно использовать для правильного выбора типа реактора, определить набор режимов и параметров (T, C, t, и др.), обеспечивающих максимальную эффективность работы реактора, а также осуществить оптимизацию режима процесса по любому целевому функционалу (x, y, S,), с целью достижения максимальной экономической и/или экологической эффективности. Наконец, знание кинетики позволяет глубже понять химию исследуемого процесса и его механизм.
2.3 Классификация реакторов химических процессов. Кинетика реакции, протекающей в реакторе идеального перемешивания или идеального вытеснения
Типы реакторов, используемых в химических процессах, подразделяют по способу подачи реагентов на периодический или статический (например, автоклав) и проточный, а по профилю концентраций и температур различают безградиентный (например, реактор идеального перемешивания) и реактор идеального вытеснения, который может быть дифференциальным (с малыми градиентами) и интегральным, в котором имеются значительные градиенты.
При изменении (возмущении) режима работы реактора, например, температуры, давления или скорости потока, возникает нестационарный режим, соответственно с неустановившейся температурой, давлением или потоком. Время перехода из одного стационарного режима в другой обычно называется временем релаксации системы, которое обратно пропорционально коэффициенту соответствующего свойства, например, теплопроводности и диффузии.
|
|
|
Обычно нестационарный режим является нежелательным, особенно в крупномасштабном производстве, поэтому наиболее распространенными являются проточные реакторы, в которых процессы тепло- и массообмена легко регулируются, и поэтому стационарный режим может быть реализован. В периодическом реакторе время реакции совпадает с отрезком астрономического времени. В проточном реакторе время реакции (или время пребывания) не зависит от астрономического времени. В кинетическом анализе обычно используются два типа модельных реакторов: идеального перемешивания и идеального вытеснения. Время пребывания в проточном реакторе τ равно отношению объема реакционного пространства к объемной скорости потока τ = VR/QA.
Для реактора идеального вытеснения, справедливы кинетические уравнения, указанные в табл. 2, при использовании вместо времени t времени пребывания t = VR/QA. Покажем это на примере реакции 1-го порядка А ® В, протекающей в цилиндрическом реакторе идеального вытеснения.
dVR





 QA
QA
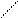 C(0)
C(0)
Рис. 13. Цилиндрический реактор идеального вытеснения: QA – объемная скорость потока, м3/с; dVR – элемент объема реактора, в котором превращается часть вещества dx.
В стационарном режиме в элементе объема накопление вещества не происходит, т.е.
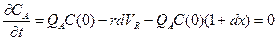 (2.31)
(2.31)
откуда rdVR= QAC(0)dx или, разделяя переменные, получим
dVR/QA = C(0)dx/r (2.32)
Левая часть уравнения 30 это дифференциал от времени пребывания t, поэтому с учетом начального условия: при t =0, x = 0 найдем общее выражение связи времени пребывания со степенью превращения для реакции, протекающей в реакторе идеального вытеснения:
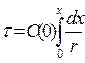 (2.33)
(2.33)
Для реакции 1-го порядка
r = kCA = kC(0)(1-x) (2.34)
подставим (2.32) в (2.31), и после взятия интеграла, получим выражение
k.t = -ln(1-х) (2.35)
аналогичное уравнению (1.21), приведенному в табл. 2.
Для реакции 1-го порядка, протекающей с изменением числа молей:
А ® В + D
выразим концентрацию реагента через конверсию:
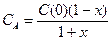 (2.36)
(2.36)
((1+x) в знаменателе появляется из-за увеличения числа молей в реакционной смеси по мере протекания реакции). Подставляя (2.34) в выражение скорости реакции, возьмем интеграл (2.31), который в этом случае имеет вид:
k.t = -2ln(1-х) – х (2.37)
Рассмотрим теперь кинетику реакции, протекающей в реакторе идеального перемешивания. Реактор идеального перемешивания является безградиентным, т.е. скорость процесса в реакторе не зависит от тепло- и массопереноса, геометрии реактора, скорости потока и др. макроскопических параметров.
  С С
 C(0) C(0)  
  С1 t1
С2 t2 С1 t1
С2 t2
| Рис. 14. Профиль концентрации реагента в объеме реактора идеального перемешивания: C(0) начальная, С1 и С2 текущая концентрация реагента; t2>t1 |
| Объем реактора |

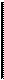
В реакторе идеального перемешивания концентрация исходного вещества уменьшается скачком на входе реакционной смеси в реактор, а смесь на выходе из реактора имеет тот же состав, что и в любой точке внутри реактора. В таком реакторе расчеты существенно упрощаются по причине отсутствия градиентов концентраций – следовательно, не надо интегрировать дифференциальные уравнения. Запишем уравнение материального баланса по исходному веществу А
QA(C0 – CA) – rVR = 0 (2.38)
или вводя время пребывания в реакторе
C0 – CA = τ.rA (2.39)
Разделив (2.37) на C0, получим
x = τ rA/C0 или τ = x C0 / rA (2.40)
Для реакции 1-го порядка rA= kCA кинетическое уравнение в реакторе идеального перемешивания примет конкретный вид:
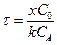 или
или 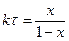 (2.41)
(2.41)
или можно записать выражение для конверсии реагента:
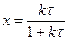 (2.42)
(2.42)
Видно, что зависимость х(τ) не содержит величины концентрации, как и в случае протекания реакции в реакторе вытеснения и в статической системе. Таким образом, для реакции 1-го порядка кривые х(τ) (или х(t)) инвариантны к концентрации исходного вещества и типу реактора.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1973; Нарушение авторских прав?; Мы поможем в написании вашей работы!