
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория элементарного акта химической реакции
|
|
|
|
Все рассмотренные выше кинетические уравнения направлены на определение констант скорости по экспериментальным данным С(τ) или х(τ). В свою очередь, константа скорости представляет собой основную величину, необходимую для проведения любых кинетических и технологических расчетов. Мы видели, что экспериментальное определения констант является достаточно трудоемкой задачей, даже в случае относительно простых реакций. Возникает вопрос, нельзя ли рассчитать константу скорости реакции, исходя из теоретических представлений, как это сделано в термодинамике для констант равновесия? С этой целью для расчета константы скорости реакции 2го порядка в теоретической кинетике были предложены 2 подхода:
1) теория активных соударений и
2) теория переходного состояния (абс. скор. реакции).
3.1 Теория активных соударений
Начнем с более простой теории активных соударений (АС), разработанной Аррениусом и Хиншельвудом в развитие 1-го и 2-го постулатов кинетики. В теории АС реагирующие частицы упрощенно считаются упругими шарами. Поскольку для протекания реакции необходимо столкновение 2 частиц (1й постулат), суммарная энергия которых ≥ Е (2й постулат), для расчета скорости реакции необходимо рассчитать число столкновений (z) в единицу времени, в единице реакционного пространства и найти долю активных соударений (ε). Произведение zε будет представлять собой расчетную скорость реакции. Активными считаются соударения, в которых система частиц имеет энергию Е≥Еa.
В качестве реакционного пространства выберем т. н. цилиндр соударений с диаметром (δAB), равным полусумме диаметров молекул А и В, и высотой, равной длине свободного пробега (l0) между двумя столкновениями. Очевидно, что l0 равна произведению средней скорости движения молекул (ω) на время между двумя столкновениями Δt.
l0=ωΔt






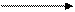 А
А
А В В δAB = ½(δA +δB)
Рис. 13. Цилиндр соударений молекул A и B
Выразим скорость движения молекул согласно кинетической теории газов
ω = [8RTμ/π] 0,5 (3.1)
где μ = (Ма + Мв)/Ма•Мв – функция молекулярных масс реагентов. Тогда число столкновений молекул А и В в единицу времени Δt, в единичном цилиндре определяется выражением:
z0 = 5,01•δAB2 [RTμ] 0,5 (3.2)
Величина z0 при единичных концентрациях А и В имеет порядок 1011 (М•с)-1. Полное число соударений в единицу времени в единице реакционного пространства равно Z = z0•nAnB, где nA и nB число молекул реагентов в указанном пространстве. Для расчета числа соударений молекул А с молекулами В и перехода к концентрации надо умножить Z на число Авогадро NA.
Доля активных соударений определяется функцией распределения молекул по энергии Максвелла-Больцмана, согласно которой
ε = = exp(-E/RT) (3.3)
= exp(-E/RT) (3.3)
Заметим, что доля активных соударений растет с температурой существенно быстрее, чем кинетическая энергия частиц. Например, при увеличении температуры от 1000 до 2000К средняя кинетическая энергия частиц увеличивается в 2 раза, а доля молекул с энергией
Е≥ 80 кДж/моль возрастает приблизительно в 150 раз.
Таким образом, перемножая уравнения 2 и 3, получим расчетное выражение скорости реакции по теории АС:
r = 5,01CACBNA δAB2 [RTμ] 0,5·exp(-E/RT) (3.4)
При сопоставлении (3.4) с уравнением кинетики r = kCACB видно, что величина константы скорости по теории АС имеет вид:
k = 5,01NA δAB2 [RTμ]0,5·exp(-E/RT), (3.5)
где А = 5,01NA δAB2 [RTμ] 0,5
Теория АС позволяет рассчитать только величину k, а энергию активации Е определяют экспериментально. Из уравнения 3.5 видно, что предэкспоненциальный множитель слабо зависит от температуры (как Т1/2). Поэтому экспериментально наблюдаемая величина Ен, найденная по уравнению Аррениуса, будет отличаться от истинной Е на величину, которую можно найти из (3.5) после логарифмирования:
ln k = lnA + ½ ln T -E/RT (3.6)
и дифференцирования этого выражения:
d(ln k) = 1/(2T) -E/RT2 = (E + ½ RT)/RT2 (3.7)
Следовательно, найденная Ен будет отличаться от истинной Еа на ½ RT. Ввиду малости этой поправки (она составляет 1-1,5 кДж/моль в интервале 300-400К и 4,2 при 1000К) величиной (½ RT) обычно пренебрегают.
Посмотрим теперь, насколько хорошо «работает» теория активных соударений. С этой целью сопоставим экспериментальные и расчетные значения предэкспоненциального множителя для некоторых газофазных реакций, приведенные в табл. 3.
Таблица 3. Параметры Аррениуса для газофазных бимолекулярных реакций
| Реакция | А, (М·с)-1 | Е, кДж/моль | f =Aэ/Aт | |
| Эксперим. | Теория | |||
| 1) 2NOCl ® 2NO + Cl2 | 9,4·109 | 5,9·1010 | 0,16 | |
| 2) Н2+СН3· ®Н· + СН4 | 6·109 | 7,5·1011 | 1,20 | 0,008 |
| 3) С2Н4 + Н2 ® С2Н6 | 1,2·106 | 7,3·1011 | 1,7·10-6 | |
| 4) K + Br2 ® KBr + Br | 1,0·1012 | 2,2·1011 | 0,0 | 4,8 (К+) |
| 5) 2HJ ® H2+ J2 | 4,1·1010 | 9,2·1010 | 178,2 | 0,45 |
Как видно из табл. 3 теория АС для реакций 1, 4, 5 дает качественное соответствие предэкспоненциального множителя в пределах порядка величины, а для реакций 2 и 3 результативными являются лишь 0,008 и 1,7 из миллиона соударений. Следовательно, кроме энергии столкновения, имеется неучтенный фактор протекания реакции. Этот стерический фактор, учитывает вероятность благоприятной конфигурации частиц при соударении. Было установлено, что, например, для протекания реакции 2 необходимо, чтобы ось молекулы водорода Н-Н при соударении была перпендикулярна плоскости метильного радикала, а для реакции 3 необходимо, чтобы оси молекул С2Н4 и Н2 были параллельны (для максимального перекрывания s–орбитали водорода c π–орбиталью этилена).
Таким образом, согласно уточненной теории АС скорость реакции определяется тремя факторами: стерическим (f), энергетическим (ε) и транспортным (Z) или
r = f.ε. Z (3.8)
причем 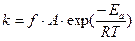 (3.9)
(3.9)
Транспортный фактор Z определяет частоту соударений молекул реагентов, энергетический фактор ε учитывает долю молекул с энергией, необходимой для реакций, а стерический фактор учитывает долю молекул с надлежащей конфигурацией при соударении.
Следовательно, теория активных соударений дает качественную оценку предэкспоненциального множителя только для сферически симметричных молекул. Очевидная недостаточность теории АС стимулировала поиск более перспективных моделей расчета скорости химических реакций. Такая модель активированного комплекса была положена в основу теории абсолютных скоростей химических реакций или:
3.2 Теория переходного состояния
Теория переходного состояния (ПС) была разработана Эйрингом и Поляни (1935) с использованием аппарата статистической термодинамики. В модели активированного комплекса (АК) или переходного состояния предполагается, что исходная конфигурация реагирующих частиц, обладающих достаточной энергией для преодоления барьера реакции, преобразуется при непрерывном изменении межатомных расстояний и соответствующей энергии системы в активированный комплекс, который обязательно превращается в продукты реакции. Например, для реакции
АА + В ® {AAB} à ABA
для превращения исходных молекул АА и В в продукты они обязательно должны образовать некий активированный комплекс ААВ (рис. 15).
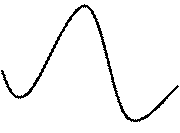 Е {AAB} Е {AAB}  δ
▲
АА+В АВА
■ δ
▲
АА+В АВА
■
 ● ●
| Рис. 15. Изменение потенциальной энергии в ходе превращения исходных веществ АА и В в продукт ABA через активированный комплекс {AAB} |
| Координата реакции, ρ |
В переходном комплексе {AAB} старые связи существенно искажены (разрыхлены), и наметились уже новые связи, однако их конфигурация и соответствующая энергия не соответствуют стабильным молекулам.
Задачи по кинетике
1. Энергия активации гидрирования ацетилена равна 40 кДж/моль. Кинетическое уравнение имеет вид:
r= k (PС2Н2)0,5 (PН2)0,5; скорость реакции при 300 К и Р(Н2)= Рац = 0,5 атм равна 1 моль/(л.с). Найти r в условиях.: вар.1) Т = 350К Рэ = 1 и РН2= 2 атм
2. Константа скорости реакции второго порядка Н2 + Cl2 = 2НСl:
k= 0,2 л/(моль.c), [H2]= 15 ммоль/л. Найти время, обеспечивающее данную степень превращения хлора (х= 75%), и количество катализатора, дающего производительность по НСl (П= 1,5 куб. м/мин); соотношение Н2 /Cl2 = 3 (моли).
3. Энергия активации распада оксида этилена равна 210 кДж/моль; время полураспада оксида: t ½ = 150 мин при 650К. Найти константу скорости реакции (1й порядок) при температуре 750К
4. При дегидрировании бутен (Со=3,0 ммоль/л) последовательно превращ. в бутадиен (Э) и в кокс. Для схемы Бà Дà К константы скорости Бà Д (0,6 с-1) и Дà К (0,3 с-1). Найти максимальную концентрацию Д (ммоль/л ) и время максимума.
5. Энергия активации гидрирования этилена равна 45 кДж/моль, а порядок реакции по С2Н4 и Н2 равен 1 и 1,5; скорость реакции при 300 К и Р(Н2)= Рэ = 1 атм равна 1 моль/(л.с). Найти скорость реакции при: Т = 350К Рэ = 2 и Р(Н2)= 2,5 атм
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1721; Нарушение авторских прав?; Мы поможем в написании вашей работы!