
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость газов
|
|
|
|
Теплоемкость – это количество тепла, которое необходимо подвести
к единице количества вещества, чтобы нагреть его на 1º.
Различают теплоемкости:
· массовую (c, Дж/кг×К), отнесенную к одному килограмму газа;
· объемную (c¢ ¢, Дж/м3×К), отнесенную к одному м3 объема при нормальных физических условиях;
· мольную (m с, Дж/кмоль×К), отнесенную к 1 киломолю газа,
 , , 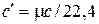 , , 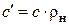 , ,
|
где rн – плотность газа при нормальных физических условиях (p =760 мм рт. ст.,
t = 0 ºС).
Согласно определению теплоемкости
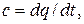
| (2.18) |
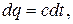
| (2.19) |
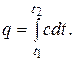
| (2.20) |
Теплоемкость реальных газов зависит от давления и от температуры 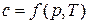 .
.
Теплоемкость идеальных газов (кроме одноатомного) зависит только от температуры  .
.
Теплоемкость одноатомного идеального газа постоянна (c = const).
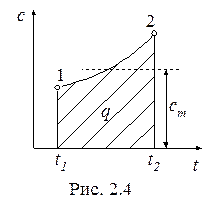 Для газов, теплоемкость которых зависит от температуры, различают истинную и среднюю теплоемкость. Формула (2.18) определяет теплоемкость при данной температуре – истинную теплоемкость.
Для газов, теплоемкость которых зависит от температуры, различают истинную и среднюю теплоемкость. Формула (2.18) определяет теплоемкость при данной температуре – истинную теплоемкость.
На рис. 2.4 показана зависимость теплоемкости газа от температуры (1-2).
Исходя из геометрического смысла интеграла, можно записать:
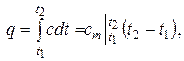
где 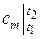 – средняя теплоемкость газа для интервала температур t 1 – t 2, которая может быть вычислена по одной из формул:
– средняя теплоемкость газа для интервала температур t 1 – t 2, которая может быть вычислена по одной из формул:
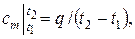
| (2.21) |
 . .
| (2.22) |
Среднюю теплоемкость 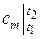 можно рассчитать:
можно рассчитать:
– по результатам эксперимента, используя формулу (2.21);
– по формуле (2.22), используя зависимость теплоемкости от температуры, например,
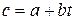 или или 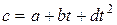 , ,
|
где a, b, d – постоянные величины;
– через средние теплоемкости 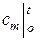 :
:
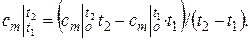
| (2.23) |
Для воздуха таблица средних теплоемкостей 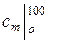 ,
, 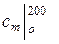 и т. д. дана
и т. д. дана
в Приложении.
Изменение температуры газа при одном и том же количестве сообщаемой теплоты зависит от характера процесса подвода теплоты, поэтому теплоемкость является функцией процесса:
· в изобарных процессах – изобарная теплоемкость 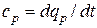 ;
;
· в изохорных – изохорная 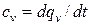 ;
;
· в изотермических – 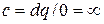 ;
;
· в адиабатных – 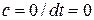 ;
;
· в политропных – 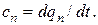

Связь изохорной и изобарной теплоемкостей для идеального газа описывает уравнение Майера
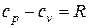 , Дж/(кг×К), , Дж/(кг×К),
| (2.24) |
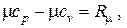 Дж/(кмоль×К). Дж/(кмоль×К).
| (2.25) |
Отношение теплоемкостей cp / cv 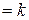 называется показателем адиабаты или коэффициентом Пуассона.
называется показателем адиабаты или коэффициентом Пуассона.
Для идеального газа
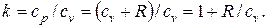
| |
| Отсюда | |
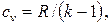
| (2.26) |
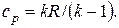
| (2.27) |
Молекулярно-кинетическая теория теплоемкости, основанная на допущении о равномерном распределении энергии по степеням свободы молекул и не учитывающая энергию внутримолекулярных колебаний, дает следующие значения мольных теплоемкостей:
- для одноатомных газов 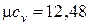 кДж/(кмоль×К);
кДж/(кмоль×К);
- для двухатомных газов 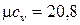 кДж/(кмоль×К);
кДж/(кмоль×К);
- для трех- и многоатомных газов 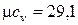 кДж/(кмоль×К).
кДж/(кмоль×К).
В одноатомных газах отсутствуют внутримолекулярные колебания и постоянное значение теплоемкости, не зависящее от температуры (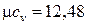 кДж/(кмоль×К)), подтверждается экспериментальными данными. Теплоемкости остальных газов зависят от температуры, и указанные значения теплоемкости подтверждаются экспериментальными данными только
кДж/(кмоль×К)), подтверждается экспериментальными данными. Теплоемкости остальных газов зависят от температуры, и указанные значения теплоемкости подтверждаются экспериментальными данными только
в области комнатных температур.
Энергию колебательного движения атомов в молекуле учитывает квантовая теория теплоемкости. Значения теплоемкостей для двух-, трех- и многоатомных газов, рассчитанные по формуле Эйнштейна, подтверждаются экспериментом и приводятся в справочниках.
Теплоемкость газовой смеси рассчитывается по формулам:
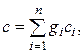 Дж/(кг×К), Дж/(кг×К),
| (2.28) |
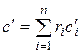 , Дж/(м3×К), , Дж/(м3×К),
| (2.29) |
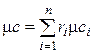 , Дж/(кмоль×К). , Дж/(кмоль×К).
| (2.30) |
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1055; Нарушение авторских прав?; Мы поможем в написании вашей работы!