
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики
|
|
|
|
3.1. Формулировки и математическое выражение
второго закона термодинамики
Формулировка Клаузиуса. Теплота не может сама собой переходить от холодного тела к горячему.
Формулировка Больцмана. Все естественные процессы являются переходом от менее вероятного состояния к более вероятному.
Формулировка Карно. Для превращения теплоты в работу необходимо иметь два источника теплоты разной температуры (рис. 3.1).
 Горячим источником в тепловых двигателях является топливо (органическое или ядерное), солнечная энергия, геотермальная энергия и т. д., холодным источником – окружающая среда.
Горячим источником в тепловых двигателях является топливо (органическое или ядерное), солнечная энергия, геотермальная энергия и т. д., холодным источником – окружающая среда.
Здесь q 1 – теплота, подводимая от горячего источника к рабочему телу в тепловом двигателе; q 2 – отводимая теплота от рабочего тела;
l – работа, полученная в тепловом двигателе.
Одна из формулировок второго закона термодинамики гласит: вечный двигатель второго рода невозможен. Это двигатель, который бы работал без холодного источника
и всю подводимую теплоту (q 1) преобразовывал в работу.
Таким образом, работа полностью превращается в теплоту, в то время как теплота превращается в работу только частично.
Математическое выражение второго закона термодинамики для обратимых процессов имеет вид

| (3.1) |

| (3.2) |
где q – подводимая (извне) или отводимая от рабочего тела теплота;
s, Дж/(кг.К)– удельная энтропия, являющаяся параметром состояния
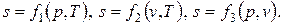
|
На основании (3.1) можно сделать следующие выводы:
При подводе тепла к рабочему телу (dq > 0) энтропия возрастает (ds > 0).
2. При отводе тепла от рабочего тела (dq < 0) энтропия убывает (ds < 0).
3. В адиабатных процессах и системах (dq = 0) энтропия не изменяется (ds = 0, s = const).
4. В изотермических процессах выполняется равенство

|
Математическое выражение второго закона термодинамики для необратимых процессов:
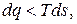
| (3.3) |

| (3.4) |
Трение и неравновесность реальных процессов сжатия и расширения относят к внутренней необратимости. Необратимый теплообмен между телами при конечной разности температур называется внешней необратимостью.
Как внутренняя, так и внешняя необратимости сопровождаются увеличением энтропии (D s H), что и учитывается уравнениями (3.3) и (3.4).
3.2. T-s -диаграмма
На рис. 3.2 в T - s- диаграмме показан произвольный процесс 1-2.
Согласно уравнениям (3.1) и (3.2) площадь под кривой (s 1-1-2- s 2) характеризует теплоту этого процесса.
Теплота подводится (dq > 0), если энтропия увеличивается (ds > 0, s 2> s 1). Теплота отводится (dq < 0), если энтропия уменьшается (ds < 0, s 2< s 1). Теплота (q), как и работа (w, l), является функцией процесса, зависит от его характера.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 396; Нарушение авторских прав?; Мы поможем в написании вашей работы!