
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные характеристики атомов элементов
|
|
|
|
• Радиус атома. - в пикометр (пм): 1 пм == 10-12 м. В каждом периоде наибольшим радиусом обладает атом элемента, стоящий в начале периода, в периоде - уменьшаются вследствие увеличения сил взаимодействия электронов с ядром.
• Относительной электроотрицательностью (ОЭО) атома элемента называют величину, характеризующую относительную способность атома элемента притягивать к себе общие электроны в молекуле.
• Энергия ионизации (Еи) - это энергия отрыва электрона от атома элемента с образованием катиона:
• Э - е- ®Э+ (Еи, кДж/моль).
• Еи, достигающее максимума для атомов благородных газов, обладающих энергетически выгодной конфигурацией ns2np6.
• Химическая связь - это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые структуры.
•. Энергия связи - энергия, выделяющаяся в процессе образования связи и характеризующая прочность этой связи (Есв, кДж/моль).
• Химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью (КС).
• Для ковалентной связи характерно:
• 1) взаимодействие между двумя атомами, несильно отличающихся по электроотрицательности;
• 2) атомы обобществляют свои валентные электроны, путем образования общих электронных пар;
• 3) одна общая электронная пара между двумя атомами соответствует одной ковалентной связи;
• 4) при взаимодействии атомов, одинаковых по электроотрицательности, образуется неполярная ковалентная связь;
• 5) при взаимодействии атомов, различающихся по электроотрицательности, образуется полярная ковалентная связь;
• К.с. может образоваться
• по обменному механизму (каждый из атомов на одну связь предоставляет по одному электрону)
• или
• по донорно-акцепторному механизму (донор предоставляет электронную пару, а акцептор - пустую валентную орбиталь).
• Для к.с. Характерны:
•: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
• Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
• Насыщаемост ь - к аждый атом в соединении способен образовывать определенное число ковалентных связей.
• Направленность обусловлена тем, что атомные орбитали, участвующие в образовании молекулярных орбиталей, имеют различную форму и разную ориентацию в пространстве и стремятся к максимальному перекрыванию.
• Молекулярная орбиталъ, в которой максимальная электронная плотность сосредоточена на прямой, соединяющей ядра атомов, называется δ-молекулярной орбиталью.
• Молекулярная орбиталь, возникающая в результате бокового перекрывания р-орбиталей взаимодействующих атомов,, называется π -молекулярной орбиталью.
• Л. Полинг предложил идею о гибридизации атомных орбиталей.
• Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме.
Ø Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром только одного из соединяемых атомов, что приводит к образованию противоположно заряженных ионов, электростатически притягивающихся друг к другу, называется ионной связью.
Ø И. с. не обладает насыщаемостью, т.к. один катион может притягивать все соседние анионы.
Ø И с. ненаправленна, электрическое поле зарядов имеет сферическую симметрию.
• Металлическая связь.
• Металлы имеют особую кристаллическую решетку, в узлах которой находятся как атомы, так и катионы металла, а между ними свободно перемещаются обобществленные электроны ("электронный газ"). Металлический тип взаимодействия является случаем предельной делокализации химической связи.
• Особые свойства металлической связи (ненаправленность,
• ненасыщаемость,
• многоэлектронность
• и многоцентровость) определяют ряд специфических физических свойств металлов и их сплавов: очень высокие значения тепло- и элекропроводности, большую пластичность, особые оптические свойства и т.д.
• Водородная связь
• может возникать между положительно поляризованным атомом водорода и отрицательно поляризованным атомом очень сильного неметалла (фтор, кислород, азот).
• То, что подобное взаимодействие не обнаруживается у других атомов, обусловлено уникальными свойствами поляризованного атома водорода (малый размер, отсутствие внутренних электронных слоев).
• Водородная связь (обозначена точками) может быть: а) межмолекулярной
• Н ¾ О×××Н ¾ О×××, H — F...... H — F
•
• Н Н
• б) внутримолекулярной (между отдельными фрагментами молекулярной структуры).
• Ряд важных физико-химических свойств молекулярных веществ определяется наличием в них водородных связей (температуры плавления и кипения, вязкость, плотность, растворимость).
Ø Квантово-механическое описание химической связи.
Ø Наибольшее распространение получили два способа - метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Ø Основные положения метода валентных связей (МВС):
Ø 1) в ходе химического взаимодействия атомы сохраняют свою физическую и химическую индивидуальность;
Ø 2) химическая связь рассматривается как возмущение, приводящее к понижению общей энергии взаимодействующих атомов при их сближении;
Ø 3) связь возникает при попарном перекрывании атомных орбиталей двух атомов;
Ø 4) связь обеспечивается наличием на перекрывшихся орбиталях пары электронов с антипараллельными спинами
Ø 5) атом может образовывать химические связи как в основном, так и в возбужденном валентном состоянии;
Ø 6) в возбужденное валентное состояние атом может перейти путем промотирования (переброса) валентных электронов с одних орбиталей на другие, если при этом:
Ø а) увеличивается количество неспаренных электронов в атоме,
Ø б) энергия, выделившаяся при образовании дополнительных связей
Ø компенсирует энергию, затраченную на промотирование;
Ø 7) валентные орбитали при перекрывании могут подвергаться гибридизации,
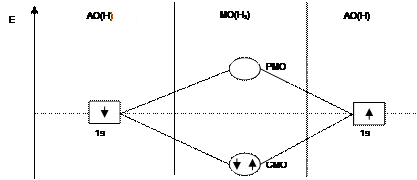
• Метод молекулярных орбиталей (ММО) предполагает, что при образовании химической связи:
• а) атомы полностью утрачивают свою химическую индивидуальность.
• б) электроны распределены по молекулярным орбиталям. Число МО на диаграмме равно числу исходных АО. МО могут быть 2 типов:
• 1) связывающие МО (СМО) характеризуются тем, что удаление с них электронов приводит к ослаблению химической связи в частице;
• 2) разрыхляющие МО (РМО) - удаление с них электронов приводит к увеличению энергии химической связи;
• Электроны заполняют МО по тем же законам, что и АО в атомах:
• а) принцип наименьшей энергии,
• б) принцип Паули,
• в) правило Хунда.
• Критерием возможности существования химической частицы является порядок связи ( ПС):
• ПС = (Nсв - Nразр)/n,
• Если ПС > 0, то данная частица может существовать. Если ПС = 0 или ПС < 0, то такая частица существовать не может
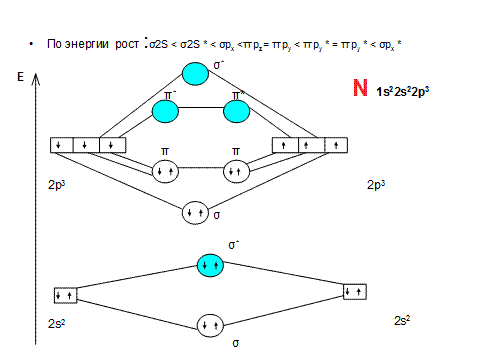
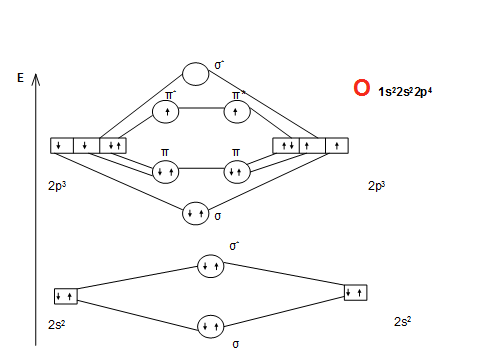
Активные формы кислорода
• O2 обладает парамагнитными свойствами (из-за неспаренных эл-ов)
ПС = (Nсв - Nразр)/n=8-4/2=2
• 1. Синглетный кислород – происходит спаривание 2 е на разрыхляющей МО у одного атома
2. Супероксидный кислород - О2 +е→О2.
• Неустойчив, активен,активирует ПОЛ – разрушает клеточные мембраны
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 3529; Нарушение авторских прав?; Мы поможем в написании вашей работы!