
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрон в атоме может находиться только в стационарных состояниях с дискретными значениями энергии En, в которых атом не излучает
ХИМИЯ - это наука о веществах и их превращениях.
- все вещества состоят из мельчайших, далее неделимых частиц - атомов (греч. атомос означает «неделимый») – (, Эпикур, Демокрит, V - III вв. до н. э.).
- -1911г. Планетарная модель Э. Резерфорда
- 1913 г. ее развил Н.Бор:
2) при переходе из одного стационарного состояния в другое атом испускает или поглощает квант электромагнитного излучения с частотой n = (En-Em)/h.
- 1920-е годы квантово-механическая модель- Л. де Бройль, В. Гейзенберг, Э. Шредингер и П. Дирак.
- Современная теория:
- Атом – наименьшая химически неделимая частица, представляющая собой сложную электромагнитную систему, состоящую из ядра и электронов.
- Ядро состоит из нейтронов и протонов По таблице Менделеева: 19 К Аr=39
- Число нейтронов = 39-19-20, протонов – 19. электронов -19.
- Электрону - присущи как свойства волны (дифракция и интерференция), так и свойства частицы (масса, заряд)
- Уравнение Л. де Бройля
λ= h/mV
- Часть атомного пространства, где вероятность пребывания электрона составляет свыше 90 %, называется атомной орбиталью.
- Электрон в атоме движется: а) вокруг ядра. Б) вокруг своей оси
Для полного описания его движения используются 4 квантового числа:
n = 1,2,3,... главное квантовое число и определяет общую энергию электрона.
L - орбитальное квантовое число, принимающее значения 0, 1, 2,..., (n-1), характеризует форму орбитали,
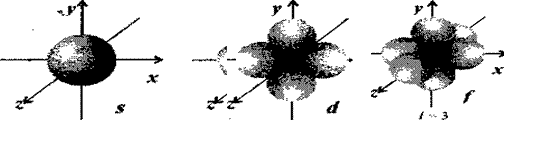
ml - магнитное квантовое число описывает направление орбитали в пространстве и принимает значения 0, ±1, ±2,...,± L.
спиновое число, которое описывает собственный момент иможет принимать лишь два значения: ±1/2
n Распределение электронов по орбиталям по 3 законам:
n 1) Принцип наименьшей энергии - в первую очередь электроны заполняют орбитали, имеющие наименьшую потенциальную энергию.
n Порядок следования орбиталей по энергии определяется по правилам Клечковского:
n 1 правило Клечковского - меньшую энергию имеет та орбиталь, для которой меньше сумма (n+L);
n 2 правило Клечковского - если у двух орбиталей сумма (n+L) одинакова, то меньшую энергию имеет орбиталь с меньшим значением главного квантового числа) и составляет следующую последовательность
n 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f и т.д.
n 2) Принцип Паули - два электрона в одном атоме не могут иметь одинаковый набор из четырех квантовых чисел.
n 3) Правило Хунда – в пределах одного подуровня электроны распределяются по орбиталям таким образом, чтобы их суммарный спин был максимален.
n Электронное строение атома записывается:
n 1. в электронной формуле указывается количество электронов на подуровнях атома: 1s2 2s2 2p6 3s2 3p6( Cl)
n 2) на энергетической диаграмме
• Периодический закон (ПЗ):
• свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда атомных ядер элементов
• ПЗ был создан Д. И. Менделеевым на основе разработанной им в 1867 г. период. Системы (таблицы).
• ПС позволяет определить электронное строение внешних уровней атомов элементов и тем самым сразу выявить особенности, определяющие их химические свойства, т. е. способность отдавать или присоединять электроны.
• Способность атома отдавать и присоединять электроны также зависит от
• его радиуса и характеризуется величинами энергии ионизации, энергии сродства к электрону,
• а в составе молекулы — относительной электроотрицательностью атома.
• Энергия сродства к электрону (Еcр) - это энергия присоединения электрона атомом элемента с образованием аниона: Э + е- ®Э- (Еср, кДж/моль).
|
Дата добавления: 2014-01-13; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!