
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физический смысл поверхностного натяжения
|
|
|
|
1. Работа, расходуемая на разрыв межмолекулярной связи. Чем сильней межмокулярные связи в данном теле, тем больше его поверхностное натяжение па границе с газовой фазой, т.е. поверхностное натяжение меньше у неполярных жидкостей со слабыми межмолекулярными связями. Большим поверхностным натяжением обладают вещества с водородными связями (вода).
2. Сила, направленная параллельно к поверхности. Поверхностные молекулы, обладая избыточной энергией, стремятся уйти вглубь конденсированной фазы и сжимают поверхность.
Как видно из определения, поверхностное натяжение конденсированных тел на границе с газом связано с межатомным и межмолекулярным взаимодействием в конденсированной фазе.
КОГЕЗИОННЫЕ И ПОВЕРХНОСТНЫЕ СИЛЫ
Когезия - взаимодействие молекул, атомов, ионов внутри одной фазы.
Работа когезии определяется затратой энергии на разрыв тела по сечению, равному единице площади.
Wк= 2s (2.9)
Точную информацию о когезии и поверхностном натяжении можно получить из термодинамической характеристики тел, связанных с парообразованием.
В процессе испарения вещества происходит полный разрыв межмолекулярных связей, поэтому работа когезии определяется энтальпией парообразования.
 Hп=
Hп= Gn+T
Gn+T Sn (2.10)
Sn (2.10)
DGп –изменение энергии Гиббса при парообразовании, DS – изменение энтропии при парообразовании. Энтальпия парообразования твердых тел равна энергии кристаллической решетки.
В состоянии равновесии при р,Т = const  Gn= 0 и тогда
Gn= 0 и тогда Н = Т
Н = Т Sn
Sn
Отсюда следует, что, чем больше энтальпия парообразования (т.е. больше работа когезии, а, значит, и поверхностное натяжение), тем больше его энтропия.
 Sn =
Sn =  So - Rln (р/ратм) (2.11),
So - Rln (р/ратм) (2.11),
где  So - изменение энтропии парообразования. При температуре кипения:
So - изменение энтропии парообразования. При температуре кипения:
При кипении р/ратм = 1
L = Ткип So
So  So = L /Тки (2.12)
So = L /Тки (2.12)
L - энтальпия парообразования приТкип.
Свойства поверхности отражают природу ионов, атомов и молекул в ней.
Для жидкостей и твердых тел когезионные силы выражаются в межмолекулярном взаимодействии, обусловленном Ван-дер-Ваальсовыми и водородными связями. Оно отличается от химического взаимодействия отсутствием специфичности и насыщаемостью, небольшими энергиями. Разрыв таких связей приводит к формированию поверхностей, способных образовывать Ван-дер-Ваальсовые и водородные связи с молекулами, попадающими на эту поверхность.
ВНУТРЕННЯЯ (ПОЛНАЯ) УДЕЛЬНАЯ ПОВЕРХНОСТНАЯ ЭНЕРГИЯ. ЗАВИСИМОСТЬ ЭНЕРГЕТИЧЕСКИХ ПАРАМЕТРОВ ПОВЕРХНОСТИ ОТ ТЕМПЕРАТУРЫ.
Для описания термодинамики поверхностных явлений применяют два метода: метод избыточных величин Гиббса и метод «слоя конечной толщины».
За толщину поверхностного слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которой свойства слоя перестают отличаться от свойств объемных фаз.
Установление границ поверхностного слоя со стороны объемных фаз трудная задача. Гиббс предложил относить все изменения термодинамических параметров в слое к разделяющей поверхности, не имеющей объема или толщины (метод избыточных величин Гиббса). Энергия Гиббса равна сумме энергий Гиббса G1 и G2 объемных фаз и поверхностной энергии s×S.
G = G1 + G2 + 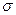 ×S (2.13)
×S (2.13)
G – энергия Гиббса системы;
G1 и G2 – энергия Гиббса объемных фаз;
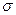 S – поверхностная энергия Гиббса.
S – поверхностная энергия Гиббса.
В методе «слоя конечной толщины» рассматривается поверхностный слой, имеющий определенные размеры, он требует знания толщины поверхностного слоя и использует сложные уравнения, так как термодинамические параметры изменяются нелинейно по толщине слоя. В методе избыточных величин не нужно определять границы слоя. Этот метод оперирует поверхностными избытками, что упрощает математические выражения.
Энтальпия поверхности (ее избыток) выражается уравнением:
Hs=Gs+TSs (2.14)
Избыточная внутренняя энергия: Us= Gs + TSs (2.15)
Индекс “s» указывает на то, что потенциалы отнесены к единице поверхности.
По 2 закону термодинамики qs= TSsтеплота образования единицы поверхности (скрытая теплота образования, она равна количеству теплоты, которую нужно сообщить телу, чтобы при постоянной температуре увеличить его поверхность на единицу площади).
Учитывая, что Gs= s, можно написать:
Us= s + qs (2.16)
Из уравнения 2.15 следует, что внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности.
Из объединенного уравнения 1 и 2 начал термодинамики, при постоянстве всех параметров, кроме температуры, имеем:
dGs = - S dT или (¶Gs/¶T)p= -S = -qs/T (2.17)
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 968; Нарушение авторских прав?; Мы поможем в написании вашей работы!