
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система элементов Менделеева
Принцип Паули
Одним из важнейших законов квантовой физики является принцип Паули (1925 г.): в одном и том же атоме (или другой квантовой системе) не может быть двух электронов (либо других частиц со спином  ), обладающих одинаковой совокупностью квантовых чисел (в одном и том же состоянии не могут находиться одновременно два электрона).
), обладающих одинаковой совокупностью квантовых чисел (в одном и том же состоянии не могут находиться одновременно два электрона).
Состояние электронов в атоме однозначно определяется набором четырех квантовых чисел:
главного n (n = 1, 2, 3,…),
орбитального l (l = 0, 1, 2, …, n – 1),
магнитного m (m = 0, ± 1, ±2, …, ± l),
магнитного спинового  (
(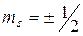 ).
).
Таким образом, принцип Паули утверждает, что два электрона, находящихся в атоме, различаются значениями, по крайней мере, одного квантового числа.
Каждому n соответствует 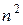 состояний, отличающихся значениями l и m. Квантовое число
состояний, отличающихся значениями l и m. Квантовое число  может принимать лишь два значения
может принимать лишь два значения  . Поэтому в состоянии с данным n может находиться не более
. Поэтому в состоянии с данным n может находиться не более  электронов.
электронов.
Совокупность электронов, имеющих одно и то же значение n, образует электронный слой (оболочку). В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Так как l принимает значения от 0 до n – 1, число подоболочек равно n. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2 (2 l + 1). В соответствии со значением n оболочки обозначают большими буквами латинского алфавита.
| n | |||||||||||||||
| Символ оболочки | K | L | M | N | O | ||||||||||
| Максимальное число электронов в оболочке | |||||||||||||||
| l | |||||||||||||||
| Символ подоболочки | 1 s | 2 s | 2 p | 3 s | 3 p | 3 d | 4 s | 4 p | 4 d | 4 f | 5 s | 5 p | 5 d | 5 f | 5 g |
| Максимальное число электронов в подоболочке |
Принцип Паули дает объяснение периодической повторяемости свойств атомов. В 1869 г. Д.И. Менделеев расположил известные в то время 63 химических элемента в порядке возрастания атомных масс и обнаружил периодичность в изменении их химических свойств. Некоторые клетки таблицы оказались незаполненными, так как соответствующие им элементы тогда еще не были открыты. Менделеев, таким образом, не только правильно расположил известные элементы, но и предсказал существование новых.
Положение элемента в периодической системе определяется количеством электронов и их распределением по квантовым состояниям. Переход к последующему атому сопровождается добавлением к его электронной конфигурации одного электрона, который занимает согласно принципу Паули состояние с наименьшей энергией.
Энергия отдельного электрона в атоме зависит от квантовых чисел n и l. Если бы электроны не взаимодействовали между собой, то электронные слои заполнялись бы последовательно, начиная с K, а подоболочки, начиная с s. При этом идеализированная таблица состояла бы из периодов, содержащих соответственно 2, 8, 18, 32, 50 электронов. В действительности же периоды содержат 2, 8, 8, 18, 18, 32 элементов, не считая элементов 7-го периода. Отступление от идеализированной системы объясняется взаимодействием электронов, которое тем существеннее, чем больше их число. Расхождения с идеализированной системой начинаются с K (Z = 19): 19-ый электрон этого атома попадает не на оболочку 3 d, а на 4 s. В этом случае полная внутренняя энергия атома K оказывается минимальной. Таблица элементов Менделеева состоит из 6 завершенных и 7-го незавершенного периода. Каждая из 8-ми групп таблицы образована двумя подгруппами элементов. Наличие подгрупп обязано своим происхождением тем элементам 4-го и 7-го периодов, у которых происходит соответственно заполнение 3 d и 6 d оболочек.
Следует отметить существенные различия физико-химических свойств у элементов разных подгрупп, но одной и той же группу. Примером могут служить железо Fe (Z = 26) и аргон Ar (Z = 18) относящиеся к 8-ой группе.
Особые группы образуют 14 элементов следующих за лантаном La (Z =57) и 14 элементов следующих за актинием Ac (Z = 89). Первые из них называют лантаноидами, а вторые – актиноидами. У лантаноидов происходит заполнение электронами 4 f -оболочки, а у актиноидов – 5 f -оболочки. Для названных элементов эти оболочки являются внутренними, и число содержащихся на них электронов никак не отражается на химических свойствах этих элементов. Таким образом, чтобы в основной части таблицы не нарушалась периодичность в повторяемости химических свойств элементов, лантаноиды и актиноиды выписываются отдельно.
|
Дата добавления: 2014-01-13; Просмотров: 286; Нарушение авторских прав?; Мы поможем в написании вашей работы!