
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет кривой титрования сильной кислоты щелочью
|
|
|
|
Пример. Титруют 100,00 см3 раствора HCl с молярной концентрацией 0,1 моль/дм3 (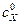 ) раствором NaOH с молярной концентрацией 0,1 моль/дм3 (
) раствором NaOH с молярной концентрацией 0,1 моль/дм3 (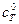 ). Рассчитайте и постройте кривую титрования с учетом разбавления раствора. Определите величину скачка ∆рН вблизи Т.Э. для уровня ошибок η = ± 1% и η = ± 0,1%. Подберите индикатор для фиксирования конечной точки титрования (КТТ).
). Рассчитайте и постройте кривую титрования с учетом разбавления раствора. Определите величину скачка ∆рН вблизи Т.Э. для уровня ошибок η = ± 1% и η = ± 0,1%. Подберите индикатор для фиксирования конечной точки титрования (КТТ).
Решение. Расчет кривой титрования ведем с учетом разбавления раствора в процессе титрования
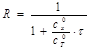 где R – степень разбавления раствора;
где R – степень разбавления раствора; 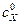 – концентрация титруемой кислоты, моль/дм3;
– концентрация титруемой кислоты, моль/дм3; 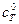 – концентрация титранта, моль/дм3; τ – степень оттитровывания раствора.
– концентрация титранта, моль/дм3; τ – степень оттитровывания раствора.
Так как 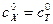 , то
, то 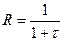 .
.
В процессе титрования протекает реакция HCl + NaOH =NaCl + H2O
Рассчитаем рН титруемого раствора, соответствующий основным моментам титрования:
а) До начала титрования τ = 0
В растворе только соляная кислота с концентрацией 0,1 моль/дм3
HCl↔H+ + Cl-
[H+] = [HCl] = 0,1моль/дм3, рН = -lg0,1 = 1
б) До Т.Э. при 0 < τ < 1. Концентрацию [H+] рассчитывают по формуле:
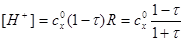 рН=-lg[H+]
рН=-lg[H+]
τ = 0,1 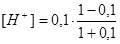 = 8,2 · 10-2 моль/дм3 рН = 1,09
= 8,2 · 10-2 моль/дм3 рН = 1,09
τ = 0,5  =0,0333 моль/дм3 рН = 1,48
=0,0333 моль/дм3 рН = 1,48
τ = 0,9 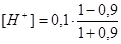 = 5,3 · 10-3 моль/дм3 рН = 2,28
= 5,3 · 10-3 моль/дм3 рН = 2,28
τ = 0,99 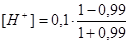 = 5,0 · 10-4 моль/дм3 рН = 3,30
= 5,0 · 10-4 моль/дм3 рН = 3,30
τ = 0,999 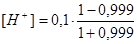 = 5,0 · 10-5 моль/дм3 рН = 4,30
= 5,0 · 10-5 моль/дм3 рН = 4,30
в) В Т.Э. при τ = 1в растворе только продукт реакции NaCl, соль, не вступающая в реакцию гидролиза
[H+] = [ОH-] = 10-7, рН=7
г) После Т.Э. τ > 1. Раствор содержит избыток ионов ОH-, концентрацию которых рассчитываем по уравнению:
 рН=14+lg[OH-]
рН=14+lg[OH-]
τ = 1,001 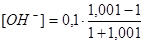 = 5,0 · 10-5 моль/дм3 рН = 9,7
= 5,0 · 10-5 моль/дм3 рН = 9,7
τ = 1,01 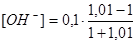 = 5,0 · 10-4 моль/дм3 рН = 10,7
= 5,0 · 10-4 моль/дм3 рН = 10,7
τ = 1,1 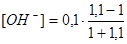 = 4,8 · 10-3 моль/дм3 рН = 11,7
= 4,8 · 10-3 моль/дм3 рН = 11,7
τ = 1,5 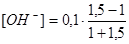 = 0,02 моль/дм3 рН = 12,3
= 0,02 моль/дм3 рН = 12,3
По полученным значениям строим кривую титрования:
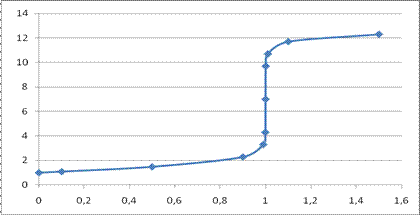
Скачок титрования ∆рН для ошибки титрования η = ± 0,1%:
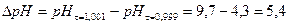
Скачок титрования ∆рН для ошибки титрования η = ± 1%:
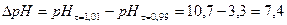
В данном случае для фиксирования КТТ можно использовать все три индикатора. Но наименьшая индикаторная ошибка титрования будет, в случае использования метилового красного (рТ = 5).
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 531; Нарушение авторских прав?; Мы поможем в написании вашей работы!