
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
По растворимости в воде
|
|
|
|
Классификация и номенклатура неорганических веществ
Находим эквивалентную массу металла из соотношения
mэ оксида = mэ металла + 8; mэ Ме = 24,3 + 8 = 32,3 г/моль.
Закон кратных отношений. Если два элемента образуют между собой несколько молекулярных соединений, то массовые количества одного элемента, приходящиеся на одно и то же массовое количество другого, относятся между собой как небольшие целые числа. Для соединений, не имеющих молекулярной структуры, массовые количества одного из них, приходящиеся на одно и то же количество другого, могут относиться между собой как дробные числа.
Нетрудно подсчитать, что в оксидах углерода СО2, СО и С3О2 массовые части углерода, приходящиеся на одну и ту же массовую часть кислорода, например на 16, относятся между собой как целые небольшие числа 1:2:3. Отношения массовых частей кислорода, приходящихся на одну и ту же массовую часть титана в оксидах переменного состава Ti00,58-1,33, TiO1,45-1,56 и TiO1,9-2,0 выражаются дробными числами. Только у оксидов стехиометрического состава TiO, T2O3(TiO1,5) и TiO2 массовые количества кислорода на постоянную массовую часть титана относятся между собой как 2:3:4.

 Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ. Как классификация, так и номенклатура химических соединений складывались на протяжении столетий, поэтому они не всегда являются логическими и отражают исторический путь развития науки.
Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ. Как классификация, так и номенклатура химических соединений складывались на протяжении столетий, поэтому они не всегда являются логическими и отражают исторический путь развития науки.
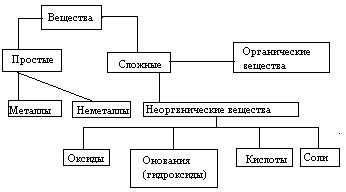
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли.
Приведенная первичная классификация уже с самого начала оказывается несовершенной. Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Перед тем, как рассмотреть более детально каждый из классов неорганических соединений, целесообразно взглянуть на схему, отражающую генетическую связь типичных классов соединений.
В верхней части схемы помещены две группы простых веществ – металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа – гелия – ему недостает также одного электрона, что роднит его с галогенами.
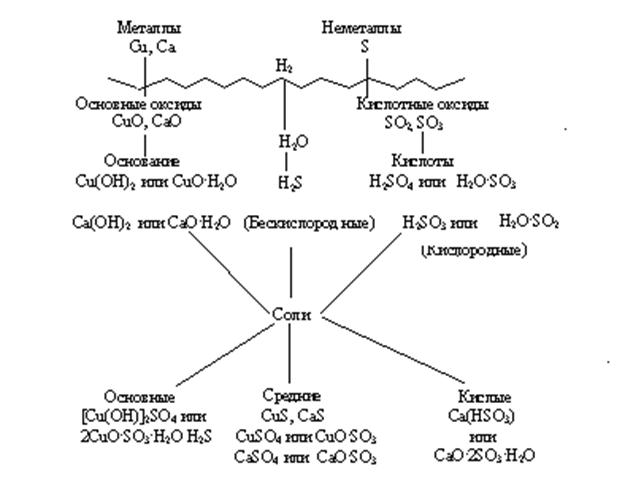
Волнистая черта отделяет простые вещества от сложных; она символизирует, что "пересечение" этой границы обязательно затрагивает валентные оболочки атомов в простых веществах, следовательно, любая реакция с участием простых веществ будет окислительно-восстановительной.
В левой части схемы под металлами помещены их типичные соединения – основные оксиды и основания, в правой части схемы помещены соединения, типичные для неметаллов, - кислотные оксиды и кислоты. Водород, помещенный в верхней части схемы, дает очень специфический, идеально амфотерный оксид – воду Н2О, которая в комбинации с основным оксидом дает основание, а с кислотным – кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой – комбинации основного оксида с кислотным.
Приведенная схема до некоторой степени отражает и возможности протекания химических реакций – как правило, в химическое взаимодействие вступают соединения, принадлежащие к разным половинам схемы. Так, основные оксиды реагируют с кислотными оксидами, кислотами и кислыми солями; кислоты реагируют с металлами, основными оксидами, основаниями, основными и средними солями. Естественно, что такая схема не дает исчерпывающей информации обо всех возможных реакциях, однако она отражает основные типы реакций.
Классификация и номенклатура оксидов
Оксид - бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды - весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом.
Соединения, которые содержат атомы кислорода, соединённые между собой, называются пероксидами (перекисями; содержат цепочку −O−O−), супероксидами (содержат группу О−2) и озонидами (содержат группу О−3). Они не относятся к категории оксидов.
В зависимости от химических свойств различают:
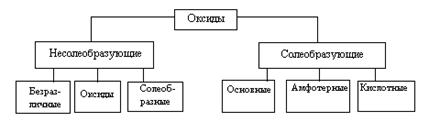
Солеобразующие оксиды:
основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Примеры получения оксидов при взаимодействии металлов и неметаллов с кислородом:
2H2 + O2 =2H2O
2Na + O2 = Na2O2
2Mg + O2 = 2MgO
4Al + 3O2 = 2Al2O3
C + O2 = CO2
2N2 + 5O2 =2N2O5
4P + 5O2 = 2P2O5
2S + 3O2 = 2SO3
При взаимодействии полученных оксидов с водой образуются кислоты или основания
Na2O2 + 2H2O = 2NaOH + H2O2
MgO + H2O = Mg(OH)2
CO2 + H2O =H2CO3
N2O5+ H2O =2HNO3
P2O5+ 3H2O = 2H3PO4
SO3+ H2O= H2SO4
Основания (гидроксиды металлов)
Основания - сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. Согласно протонной теории кислот и оснований, основания - один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов.
Основания классифицируются по ряду признаков.
Растворимые основания (щёлочи): гидроксид лития LiOH, гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2. Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов. Исключение составляет гидроксид лития LiOH, хорошо растворимый в воде, но являющийся слабым основанием.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1029; Нарушение авторских прав?; Мы поможем в написании вашей работы!